
阿佛加德罗常数为6?02×1023 mol?1。下列叙述中不正确的是
A.0.1 mol OH-含有6?02×1023 个电子
B.氯化氢气体的摩尔质量等于6?02×1023个氯化氢分子的质量之和
C.1 mol醋酸的质量与6?02×1023个醋酸分子的质量相等
D.28 g氮气所含的原子数目为12?04×1023
科目:高中化学 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如图所示:
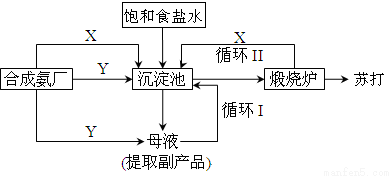
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)_____________、______________。
(2)侯氏制碱法的最终产物是(化学式)_______________;其在水溶液中显著的实质是(离子方程式):__________________。
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:______________、_____________。这两种气体在使用过程中是否需要考虑添加的顺序?____________(填“是”或“否”),原因是_______________。
(4)在沉淀池中发生的反应的化学方程式是_________________。
(5)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了_____________(填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是______________(举一例)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:填空题
(16分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+CO2(g)+ 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g)+ 4NO(g)= 2N2(g)+CO2(g)+ 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+ 3CH4(g) 2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
2Fe(s)+ 3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
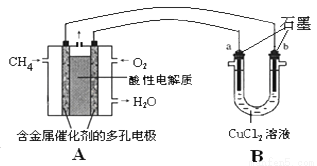
请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:选择题
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
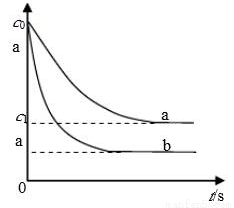
A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K=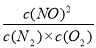
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
在t℃时,将agNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg•cm-3,质量分数为ω,其中含NH4+的物质的量为bmol.下列叙述正确的是
A.溶质的质量分数ω=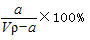
B.溶质的物质的量浓度c=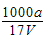 mol/L
mol/L
C.溶液中c(OH-)=1000b/Vmol/L
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
往含等物质的量的偏铝酸钠溶液与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是
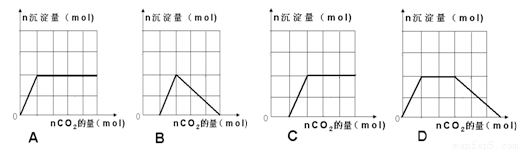
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学高一上10月阶段测化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法中正确的是
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.标准状况下,11.2L CCl4所含的分子数为0.5NA
C.0.5mol/L AlCl3溶液中Cl—的数目为2NA
D.17g氨气中含有的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com