
【题目】可用于分离蛋白质,并保持其生理活性的物质是( )
A. 福尔马林 B. 酒精 C. 硫酸铜 D. 硫酸铵
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学家发现宇宙深处存在一行星,经实验测试知该行星大气中存在大量的H2C=CHOH物质。已知H2C=CHOH并不稳定,在常温下为液体,很容易转化成稳定的CH3CHO,该星球的温度是
A. 较低 B. 较高
C. 无法判断温度的高低 D. 以上说法均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH2C(CH3)2CH(C2H5)CH3的准确命名是
A. 3,4 —二甲基— 4 —己基戊烷 B. 3,3,4 —三甲基己烷
C. 3,4,4 —三甲基己烷 D. 2,3,3 —三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)既可以作氧化剂又可以作还原剂,当它在反应中作氧化剂时,可能生成的产物是( )
A.N2B.N2O3C.HNO3D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH。回答下列问题:
(1)CH3SH(甲硫醇)的电子式为________。
(2)一种脱硫工艺为:真空K2CO3—克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK2=-10.3;H2SlgK1=-7,lgK2=-19)。
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) △H1=-1172kJ/mol
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2=-632kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为__________。
(3)Dalleska等人研究发现在强酸溶液中可用H2O2氧化COS。该脱除反应的化学方程式为______________。
(4)COS水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H=-35.5kJ/mol。
CO2(g)+H2S(g) △H=-35.5kJ/mol。
用活性α-Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS,COS的平衡转化率如图2所示。
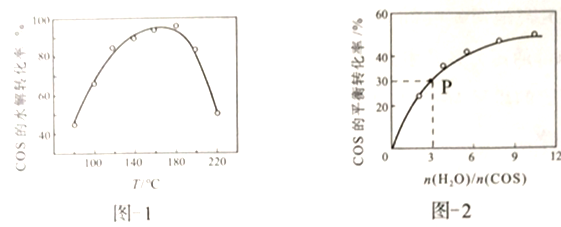
①图1活性α-Al2O3催化水解,随温度升高转化率先增大后又减小的可能原因是________。
②由图2可知,P点时平衡常数为K=______(填数字)。
③活性α-Al2O3催化水解,为提高COS的转化率可采取的措施是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对教材中有关数据的叙述不正确的是![]()
![]()
A. 利用沸点数据可以推测将一些液体混合物分离开来的可能性
B. 通过比较溶度积常数![]() 与溶液中有关离子浓度幂的乘积--离子积
与溶液中有关离子浓度幂的乘积--离子积![]() 的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解
的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解
C. 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性
D. 根据分散质粒子直径的大小,可以判断分散系的类别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法错误的是
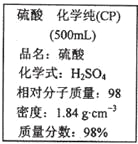
A. 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管
B. 取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸
C. 配制200mL4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
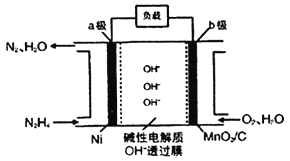
N2H4的电子式为___________;a极的电极反应方程式为___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com