
【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
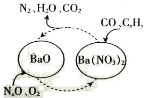
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
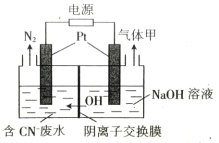
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
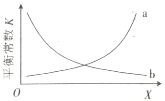
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
【答案】NO+NO2+BaO+O2= Ba(NO3)2 被还原 增大 2CN--10e-+12OH-=2CO![]() +N2↑+6H2O -745 温度 b 1.25 0.15mol·L-1·min-1 75%
+N2↑+6H2O -745 温度 b 1.25 0.15mol·L-1·min-1 75%
【解析】
(1)根据题意可知反应物为NO、NO2、BaO、O2,且NO和NO2系数比为1:1产物为Ba(NO3)2,根据电子守恒和元素守恒可得化学反应方程式为NO+NO2+BaO+O2= Ba(NO3)2;最终产物中N元素的存在形式为N2,所以氮元素将被还原;
(2)电解过程CN-转变为N2,氮元素化合价升高发生氧化反应,所以产生左侧为电解池的阳极,氮元素被氧化的同时碳元素也被氧化,由于阴极区的氢氧根会迁移到阳极区,所以碳元素的最终存在形式为碳酸根,电极反应式为2CN--10e-+12OH-=2CO![]() +N2↑+6H2O;右侧为电解池的阴极,水电离出的氢离子放电产生氢气,同时会产生氢氧根,电极反应式为2H2O+2e-=H2↑+2OH-,水减少导致NaOH溶液浓度变大,pH增大;
+N2↑+6H2O;右侧为电解池的阴极,水电离出的氢离子放电产生氢气,同时会产生氢氧根,电极反应式为2H2O+2e-=H2↑+2OH-,水减少导致NaOH溶液浓度变大,pH增大;
(3)①焓变=反应物键能之和-生成物键能之和,所以该反应的ΔH=2×630kJ/mol+2×1076kJ/mol-945kJ/mol-4×803kJ/mol=-745kJ/mol;
②平衡常数只与温度有关,所以X时温度;该反应焓变小于零,正反应为放热反应,所以温度升高平衡常数减小,则曲线b可以正确表达平衡常数随温度的变化;
(4)①容器体积为2L,根据题意列三段式为:

则有2-8x=0.5,所以8x=1.5,则有0.5n-2x=0.5n-0.375=0.25,解得n=1.25;
②根据三段式可知10min内Δc(NO)=1.5mol/L,所以v(NO)=![]() =0.15mol·L-1·min-1;
=0.15mol·L-1·min-1;
③NH3的平衡转化率为![]() ×100%=75%。
×100%=75%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,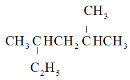 的名称为2,4-二甲基己烷
的名称为2,4-二甲基己烷
B.等质量的甲醇、甲醛完全燃烧时的耗氧量后者更多
C.将甲醇、乙醇和浓硫酸混合加热,最多得到3种有机产物
D.向丙烯醛(![]() )中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
)中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氮、磷等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为________。
(2)常见含硫的物质有![]() ,
,![]() ,
,![]() ,该三种物质中熔点最高的是________(填化学式)。
,该三种物质中熔点最高的是________(填化学式)。
(3)将过量的![]() 通入
通入![]() 溶液中可以得到
溶液中可以得到![]() ,
,![]() 中第一电离能最大的是________(填元素符号)。
中第一电离能最大的是________(填元素符号)。![]() 、
、![]() 和
和![]() 的价电子对数均为4,但键角不同,其原因是________。
的价电子对数均为4,但键角不同,其原因是________。
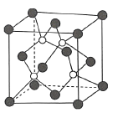
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应得到。磷化硼晶体的晶胞结构如图所示,该晶胞中含有________个B原子。已知该晶胞的边长为![]() ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为![]() ,则磷化硼晶体的密度为________
,则磷化硼晶体的密度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
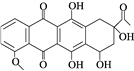
A. 每个柔红酮分子中含有2个手性碳原子
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 1 mol柔红酮最多可与2 mol Br2发生取代反应
D. 一定条件下柔红酮可发生氧化、加成、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.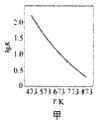 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.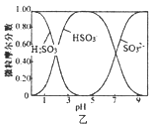 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C.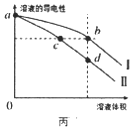 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.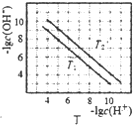 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
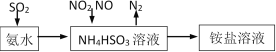
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物
B. a、b和c均能使酸性KMnO4溶液褪色
C. a和c分子中所有碳原子均处于同一平面上
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
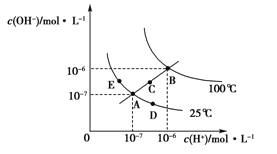
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com