
【题目】下列说法正确的是( )
A.按系统命名法,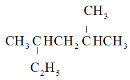 的名称为2,4-二甲基己烷
的名称为2,4-二甲基己烷
B.等质量的甲醇、甲醛完全燃烧时的耗氧量后者更多
C.将甲醇、乙醇和浓硫酸混合加热,最多得到3种有机产物
D.向丙烯醛(![]() )中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
)中滴入溴水,若颜色褪去就能证明结构中存在碳碳双键
【答案】A
【解析】
A.最长的碳链上含有6个碳原子,在2号碳原子和4号碳原子上各连有一个甲基,故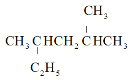 的系统命名法为:2,4-二甲基己烷,故A正确;
的系统命名法为:2,4-二甲基己烷,故A正确;
B.将甲醇、甲醛的分子式分别改写成CH2(H2O)、C(H2O),等质量的甲醇、甲醛、完全燃烧时的耗氧量相当于等质量的CH2、C燃烧耗氧量判断,根据等质量烃中氢质量分数越高,其完全燃烧耗氧量越高可判断,甲醛所需耗氧量最少,完全燃烧时的耗氧量后者更少,故B错误;
C.将甲醇、乙醇和浓硫酸混合,在一定条件下反应,生成甲醚、乙醚、甲乙醚、乙烯,最多得到4种有机产物,故C错误;
D.向丙烯醛(CH2=CHCHO)中滴入溴水,碳碳双键能被加成、CHO能被氧化,则不能证明含有碳碳双键,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】100mL某混合液中,硝酸和硫酸的物质量浓度分别是0.4mol·L-1,0.1mol·L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质量浓度是( )
A.0.15 mol·L-1B.0.225 mol·L-1C.0.35 mol·L-1D.0.45 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
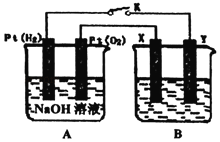
【题目】某化学兴趣小组用如图所示装置进行电化学原理的实验探究,冋答下列问题:
(1)通入O2的Pt电极为电池的_____(填“正极”或“负极”),电极反应式为_____。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_____(填“镀件”或“银”)。
(3)若B电池的电解质溶液为500mL1.0molL﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因_____。当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的pH=_____(假设溶液体积不变),转移电子的数目为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X具有消炎功效,为测定其结构,某化学小组设计如下实验探究过程:
I. 确定X的分子式
(1)确定X的实验式。将有机物X的样品充分燃烧,对燃烧后的物质进行定量测量,所需装置及试剂如下所示:
A.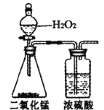 B.
B. C.
C. D.
D.
①装置的连接顺序是________。(填字母,部分装置可重复使用)
②取X样品6.9g,用连接好的装置进行实验,X样品充分燃烧后,测得B管增重15.4g,C管增重2.7g,则X的实验式为________。
(2)确定X的分子式。X的质谱图中分子离子峰对应的质荷比最大为138,则X的分子式为________。
Ⅱ. 确定的结构
(3)确定X的官能团。红外光谱图呈现,X中有O-H、C-O、C-C、苯环上的C-H、羧酸上的C=O等化学键以及邻二取代特征振动吸收峰,由此预测X含有的官能团有________(填名称)。
(4)确定X的结构式。核磁振动氢谱如下图所示,X的结构简式为________。
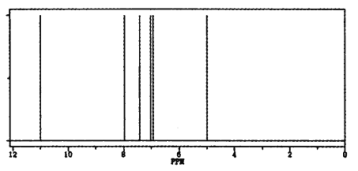
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。查阅资料得到下列数据:
物质 | 沸点/℃ | 密度/ | 相对分子质量 | 水溶性 |
乙醇 | 78.0 | 0.8 | 46 | 互溶 |
乙酸 | 118.0 | 1.1 | 60 | 可溶 |
乙酸乙酯 | 77.5 | 0.9 | 88 | 微溶 |
乙醚 | 34.6℃ | 0.7 | 74 | 微溶 |
浓硫酸(98%) | 338.0 | 1.8 | 98 | 易溶 |
无水氯化钙 | 可与乙醇形成难溶于水的CaCl2·6C2H5OH | |||
请回答以下问题:
(1)实验室常用下图装置来制备乙酸乙酯。
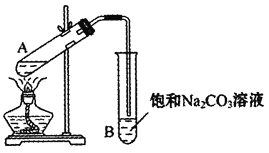
①配制反应混合液时,乙醇、冰醋酸和浓硫酸的混合顺序是________;浓硫酸对反应有催化作用,但加入的浓硫酸不能太多也不能太少,原因是________。
②防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是________。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③实验中饱和碳酸钠溶液的作用是________。
(2)产品纯化。分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,除去________(填名称);然后再加入无水硫酸钠除去水,最后进行________(填操作名称),得到较纯净的乙酸乙酯。
(3)该实验中用30 g乙酸与46 g乙醇反应,如果实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是________。(产率指的是某种生成物的实际产量与理论产量的比值)
(4)另一化学小组设计下图所示的装置制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)。此装置和上图装置相比的优点是________(写出一条即可)。
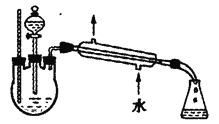
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
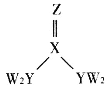
且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是
A.YW3分子中的键角为120°
B.W2Z的稳定性大于YW3
C.物质甲分子中存在6个σ键
D.Y元素的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的
溶液,溶液的![]() 随
随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 下列说法不正确的是( )
下列说法不正确的是( )
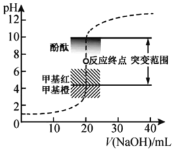
A.![]() 与盐酸恰好完全反应时,溶液
与盐酸恰好完全反应时,溶液![]()
B.![]() 时,溶液
时,溶液![]()
C.![]() 标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定
标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定![]() 溶液的浓度,标定时可采用甲基橙为指示剂
溶液的浓度,标定时可采用甲基橙为指示剂
D.选择甲基红指示反应终点,误差比甲基橙的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.丙烯分子中所有原子有可能共平面
B.等质量的乙醇和乙烯完全燃烧生成CO2的质量不相等
C.甲醛(HCHO)和乙二醛(OHC—CHO)互为同系物
D.![]() 和
和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
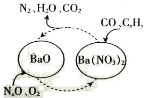
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
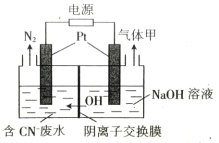
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
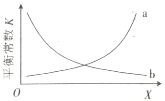
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com