
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��(����ƽ���ϵ�����ں�����)
__ C+ __ KMnO4+ ___ H2SO4��___CO2��+ ___MnSO4 + ___K2SO4+ ___H2O
����Ӧ����2��408��1024�����ӷ���ת��ʱ����ԭ��������Ϊ
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO��g����H2O��g��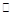 CO2��g����H2��g�����õ������������ݣ�
CO2��g����H2��g�����õ������������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2��0 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2��0 | 1��0 | 0��4 | 1��6 | 3 |
��1��5��4��6��5��4��2��6 ��2�֣��� 12g ��2�֣�
��2���� 0��13 mol��L-l�� min-l��2�֣��� 0�� 53��2�֣�
�� �����¶ȣ�2�֣� �� ����2�֣� ��B D��2�֣�
��3�� 3(2a+b)/80��2�֣� ��
4CO (g)+2NO2(g) ��4CO2(g) )+ N2 (g) ��H��-(2a+b) kJ��mol ��2�֣�
���������������1�����ݻ��ϼ���������ƽ�÷�Ӧ�������������Ԫ�ػ��ϼ۽���5�ۣ�̼Ԫ�ػ��ϼ�����4�ۣ����ϼ����������ڻ��ϼ۽����������Ը������ǰ��ϵ����4��̼����ǰ��ϵ����5������ԭ���غ㣬��ƽ�������ʵ�ϵ������ƽ���£�5 C+ 4 KMnO4+ 6 H2SO4�T 5CO2�� + 4MnSO4 + 2 K2SO4+ 6 H2O���÷�Ӧת�Ƶ�������20������Ӧ����2��408��1024�����ӷ���ת��ʱ����ԭ��̼��������Ϊm���� �����m="12" g ��
�����m="12" g ��
��2����ʵ��1�дﵽƽ��ʱ����CO2�����ʵ�������H2�����ʵ���Ϊ1��6mol������v(CO2)=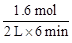 =0��13 mol��L-l�� min-l��
=0��13 mol��L-l�� min-l��
ʵ��2�ﵽƽ��ʱCO�������������ɸ������η����£�
CO(g)+H2O(g)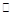 H2(g)+CO2(g)
H2(g)+CO2(g)
��ʼ��/mol 2��0 1��0 0 0
ת����/mol 0��4 0��4 0��4 0��4
ƽ����/mol 1��6 0��6 0��4 0��4
ʵ��2�ﵽƽ��ʱCO���������Ϊ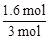 =0��53��
=0��53��
�ڸ������η������ͬ�¶��µ�ƽ�ⳣ����K(650��)=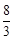 ��K(900��)=
��K(900��)= �������¶�ƽ�ⳣ����С����֪�����¶�ƽ�������ƶ����ָı�ѹǿ�Ը÷�Ӧƽ����Ӱ�죬��������÷�Ӧƽ�ⳣ���Ĵ�ʩֻ���ǽ����¶�ʹƽ�������ƶ���
�������¶�ƽ�ⳣ����С����֪�����¶�ƽ�������ƶ����ָı�ѹǿ�Ը÷�Ӧƽ����Ӱ�죬��������÷�Ӧƽ�ⳣ���Ĵ�ʩֻ���ǽ����¶�ʹƽ�������ƶ���
�۸������µ�Ũ�Ȼ�Qc=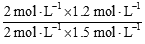 =0��8��K(900��)��ƽ�����淴Ӧ�����ƶ�����v�� ��v����
=0��8��K(900��)��ƽ�����淴Ӧ�����ƶ�����v�� ��v����
��A���÷�ӦΪ���巴Ӧ����Ӧǰ�������ʵ������䣬���������غ㣬���������ƽ������������ʱ����仯������B������1 mol H2��ͬʱ����1 mol CO�����������淴Ӧ������ȣ���ȷ��C���̶�������ܱ��������������䣬������䣬�����ܶ�Ҳ���ı䣬����D��CO2�������������ʱ����仯����ȷ��
��3�����ݸ�˹���ɣ���+�� 2�õ���
2�õ���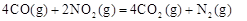 ��H="-(2a+b)kJ/mol" ��3��36 L CO��ԭNO2��N2ʱ�ų�������Ϊ
��H="-(2a+b)kJ/mol" ��3��36 L CO��ԭNO2��N2ʱ�ų�������Ϊ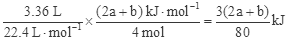 ��
��
���㣺������ԭ��Ӧ����ƽ�ͼ��㣬��ѧ��Ӧ���ʼ��㣬ƽ��״̬��־���жϣ���ѧƽ��ļ��㣬��˹���ɵļ��㡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ �����÷�Ӧ6NO2�� 8NH3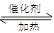 7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��2SO2��g��+O2��g��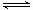 2SO3��g�� ��H="-196.6" kJ��mol-1
2SO3��g�� ��H="-196.6" kJ��mol-1
2NO��g��+O2��g��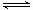 2NO2��g�� ��H="-113.0" kJ��mol-1
2NO2��g�� ��H="-113.0" kJ��mol-1
��ӦNO2��g��+SO2��g��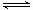 SO3��g��+NO��g���Ħ�H= kJ��mol-1��
SO3��g��+NO��g���Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��[��Դ:Z|xx|k.Com]
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 molNO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1:6����ƽ�ⳣ��K�� ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��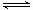 CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��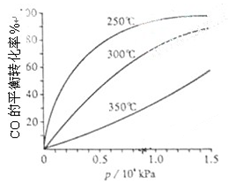
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������(K2FeO4)���к�ǿ�������ԣ����������������й㷺Ӧ�á�
��1��K2FeO4��������Чˮ�����������������÷ֱ��ǣߣߣߣߣߡ�
[��֪��FeO42����3e����4H2O Fe(OH)3��5OH��]
Fe(OH)3��5OH��]
��2���Ʊ�K2FeO4���Բ���ʪʽ����������������ͼ��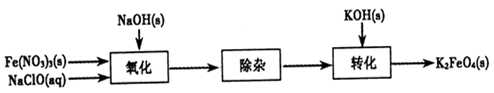
�����������������ӷ���ʽ��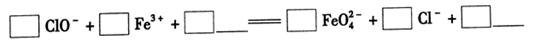
�ڳ��ӹ���Ŀ���dz�ȥNa��FeO4��Һ�е����ʣ���ȥ��������Ҫ�Уߣߣߣߣ�(д��ѧʽ)��
��ת�����������ij�¶��½��У�����¶����ܽ�ȣ�Na��FeO4�ߣߣߣߣ�K2FeO4 (�����������������)��
��3��ʵ����ģ�ҵ��ⷨ��ȡK2FeO4��װ������ͼ��
�ٴ�װ���е�Դ�ĸ����ǣߣߣߣ�(�a����b��)��
�������ĵ缫��ӦʽΪ�ߣߣߣߣߣߡ�
��4����֪K2FeO4ϡ��Һ�д�������ƽ�⣺4FeO42����10H2O 4Fe(OH)3��8OH����3O2��ʵ����K2FeO4��ҺŨ�����¶Ⱥ�pH�Ĺ�ϵ�ֱ�����ͼ��ʾ��
4Fe(OH)3��8OH����3O2��ʵ����K2FeO4��ҺŨ�����¶Ⱥ�pH�Ĺ�ϵ�ֱ�����ͼ��ʾ��
����ͼI�ɵó��Ľ��ۣ��÷�Ӧ�ġ��ȣߣߣ�0(�����������������)��
��ͼ����pH���ߣߣ�pH3(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʳ�Ρ�̼���ƺ�̼�������������г��������Ρ���ش��������⡣
��1��̼�����Ƶ�ˮ��Һ��__________�ԡ�����ᡱ��������С�������ȥ̼���ƹ����л��е�����̼�����ƣ���Ӧ�Ļ�ѧ����ʽΪ_________________��
��2����������̼���ƺ�̼�����Ʒֱ����������ᷴӦʱ���ɵ�CO2����ǰ��________���ߣ��>������<����=������
��3�����κ����������ʣ���ҪΪCaCl2��MgCl2��Na2SO4�ȣ����ô�����ȡ����ѧ��������NaCl������Ϊ�ܽ⡢�ӹ���a���ӹ���NaOH���ӹ���b�����ˡ����������ᣬ�����ᾧ�õ�����ѧ��������NaCl���塣�Լ�a��b�ֱ���________(����ţ�
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
��4����ҵ���õ�ⱥ��ʳ��ˮ�ķ��������������ռ
��ij��������������й©�¼���������Ա����NaOH��Һ�γ�ҺĻ����Χ������й©���������䷴Ӧԭ��_________________________________�������ӷ���ʽ��ʾ����
�ڹ�ҵ�Ͽ��ð��������������Ĺܵ��Ƿ�©������Ӧ����ʽ���£� �÷�Ӧ�У�____________Ԫ�ر���ԭ���÷�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ__________��
�÷�Ӧ�У�____________Ԫ�ر���ԭ���÷�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�����ú���һ��Ũ�ȵ�I2��CuSO4��Һ�Ĺ�ҵ��ˮ�Ʊ��������Ӽ�Ca(IO3)2,�������������£�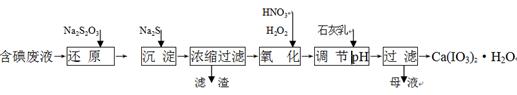
��֪��Ca(IO3)2����ˮ,�������Ksp(CuI)=1.1��10-12, Ksp(Cu2S)=2.5��10-48��
������: HNO3��IO3����H2O2
��1������ԭ����������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2Na2S2O3��I2 = �� 2NaI��
��2���ڻ�ԭ���̻�������CuI���ɣ�д������Na2S�����ӷ�Ӧ����ʽ ��
��3���������������ȼ���H2O2�ټ���Ũ���ᣬ����ֱ�Ӽ���Ũ�����Ŀ���� ��
��4�������ʯ��������Һ�з�Ӧ���õ�Ca(IO3)2����Ҫ����pH�� ������ԡ� �����ԡ����ԡ�����ԭ���� ��
��5��Ca(IO3)2Ҳ���õ绯ѧ��������ȡ���ȳ�ֵ��KI��Һ��Ȼ���ڵ������Һ�м���CaCl2�������˵õ�Ca(IO3)2��д�����ʱ���������ĵ缫��Ӧ����ʽ ,�ø÷�����ȡCa(IO3)2��ÿ1kg�⻯�������Ͽ���������Ϊ97.8%Ca(IO3)2������Ϊ ____kg������������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ԭ��Ӧ�������������о��й㷺����;���ᴩ�Ž�
��1��ˮ���������Ҫ��ɳɷ֣��������к�������һ�����ʡ��������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��Ҳ������ͼ���
��д����ˮ�μӵķ��Ϸ�Ӧ���͢���һ����ѧ����ʽ��________________________________��
����ˮΪ_______����
��2���Ȼ�麟��������ӡ��磺�ں���ͭ��ʱ���Ȼ�麟�ȥͭ�����������ͭ�Ա㺸�ӣ��䷴ӦΪ��
_____CuO+_____NH4Cl _____Cu+_____CuCl2+N2��+_____H2O��
_____Cu+_____CuCl2+N2��+_____H2O��
����ƽ��������ԭ��Ӧ����ʽ��
�ڸ÷�Ӧ�У���������Ԫ����_______����Ԫ�����ƣ�����������_______���ѧʽ����
��3��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1 500 �����ɰ��ף���ӦΪ��2Ca3��PO4��2+6SiO2=6CaSiO3+P4O10��10C+P4O10=P4+10CO��ÿ����1 mol P4ʱ������_______mol���ӷ���ת�ơ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�ٶ��ֻ�ѧԪ���У��ǽ���ռ��23�֡�80%�ķǽ���Ԫ���������ռ��Ҫλ�á���C��N��O��Si��Cl�ȡ�
��1����Ԫ��ԭ��������Ӳ����� ��������ͬ�ĵ��ӣ���Ԫ�صļ������Ӻ�������Ų�ʽ�� ��
��2���ɵ�Ԫ�����Ԫ����ɵ����ʣ����������췢���������Ȳ�������Ϊ������ ���壬��д���û�����Ļ�ѧʽ ��
��3��������ʵ��˵����������Ԫ�طǽ��������ǿ������ ����ѡ���ţ�
a��Clԭ������������������
b�����ԣ�HCl��H2O
c��ClO2����Ԫ��Ϊ+4�ۣ���Ԫ��Ϊ?2��
d���е㣺H2O��HCl
��Cl2��Ƚϣ�ClO2����ˮʱ����ԭ��Cl�����������л��ȴ�����к����ʡ���ҵ�Ͽ����������ƺ�ϡ����Ϊԭ���Ʊ�ClO2����Ӧ���£�NaClO2 +HCl ClO2��+___________________��û����ƽ��
ClO2��+___________________��û����ƽ��
��4����������ʽ�У�ȱ��������___________����ƽ����ʽ���������油ȫ��Ӧ��ϵ����____NaClO2 +____HCl
��5���÷�Ӧ���������ͻ�ԭ�������ʵ���֮���� ������0.2 mol ClO2ת�Ƶ��ӵ����ʵ���Ϊ_______ mol��
��6��ClO2����ˮ��Fe2����Mn2����S2����CN���������Ե�ȥ��Ч����ij��ˮ�к�CN��a mg/L������ClO2��CN��������ֻ�������������塣����100m3������ˮ��������ҪClO2 _______ mol ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����6 mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ��
��ش��������⣺
��1��b��ʱ��KI��Ӧ��ȫ�������ĵ��������뻹ԭ�����ʵ���֮��Ϊ ��
��2����֪b��c�����У�����һ��Ԫ�ط������ϼ۱仯��д������ƽ�÷�Ӧ�����ӷ���ʽ ________________________________________��
��3��n(KBrO3) = 4ʱ����Ӧ�������ʵĻ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2KMnO4+16HCl=2MnCl2+5Cl2��+8H2O+2KCl���������Ӧ�У��������� ������������ ����˫���ű�����ӵ�ת�Ʒ������Ŀ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com