
| 选项 | 实验操作及现象 | 实验结论 |
| A | 分别点燃乙烯和乙炔,乙炔产生的黑烟更浓 | 乙炔的含碳量高于乙烯 |
| B | 在滴有酚酞的Na2CO3溶液中加入BaCl2溶液后红色褪去 | BaCl2溶液呈酸性 |
| C | 分别取绿豆大的钾和钠,用滤纸吸干表面的煤油,投入盛水的烧杯中,钾反应更剧烈 | 钾的金属性比钠强 |
| D | 测定相同浓度的盐酸和磷酸溶液的pH:盐酸的pH较小 | 氯的非金属性比磷强 |
科目:高中化学 来源:不详 题型:单选题
| A.与C60中普通碳原子的化学性质不同 | B.与14N含的中子数相同 |
| C.是C60的同素异形体 | D.与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |
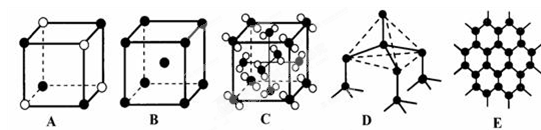
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | | Y | |
| Z | | W | Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com