
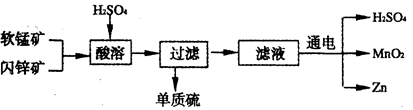
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
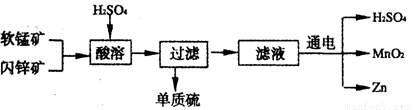
下列说法正确的是
A.酸溶时,MnO2作还原剂 B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用 D.在电解池的阴极处产生MnO2
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省淄博市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
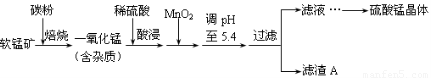
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州市毕业班质量检查理综化学试卷(解析版) 题型:填空题
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______ (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
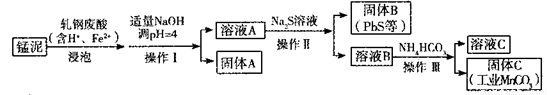
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中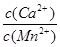 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com