
 NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.分析 (1)①2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
盖斯定律计算(②-①)×$\frac{1}{2}$得到;
(2)发生的反应为:2NO2+2OH-═NO2-+NO3-+H2O,反应中生成亚硝酸根、硝酸根和水,形成的化学键是共价键;用NaOH溶液吸收少量SO2反应生成亚硫酸钠和水;
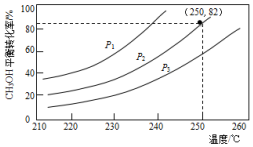
(3)①反应达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,以及衍生的各种物理量变量不变;
②如果要将图中C点的平衡状态改变为B点的平衡状态,平衡转化率增大,平衡正向进行;
③A.点平衡转化率为50%,n(NO2):n(SO2)=0.4,反应速率v=$\frac{△c}{△t}$;
④图中C、D两点对应的实验温度分别为Tc和Td,C点二氧化氮转化率为50%,D点二氧化氮转化率40%,计算CD点对应反应的平衡常数判断反应温度高低.
解答 解:(1)①2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
盖斯定律计算(②-①)×$\frac{1}{2}$得到 NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8KJ/mol,
故答案为:-41.8KJ/mol;
(2)发生的反应为:2NO2+2OH-═NO2-+NO3-+H2O,反应中生成亚硝酸根、硝酸根和水,形成的化学键是共价键;用NaOH溶液吸收少量SO2反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:共价键;SO2+2OH-=SO32-+H2O;
(3)NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8KJ/mol,反应为气体体积不变的放热反应,
①a.反应前后气体物质的量不变,气体的压强始终不变,不能说明反应达到平衡状态,故a错误;
b.气体质量不变,气体物质的量不变,气体的平均摩尔质量始终不变,不能说明反应达到平衡状态,故b错误;
c.反应前后气体质量不变,气体体积不变,气体的密度始终不变,不能说明反应达到平衡状态,故c错误;
d.NO2的体积分数不变是平衡标志,故d正确;
故答案为:d;
②如果要将图中C点的平衡状态改变为B点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度平衡正向进行复核,故答案为:降低温度;
③A.点平衡转化率为50%,n(NO2):n(SO2)=0.4,SO2(g)的起始浓度为c0 mol•L-1,NO2起始浓度c(NO2)=0.4c0mol/L,反应的二氧化氮浓度=0.4c0mol/L×50%=0.2c0mol/L,
该时段化学反应速率v(NO2)=$\frac{0.2cmol/L}{tmin}$mol/(L•min)=$\frac{{c}_{0}}{5t}$mol/(L•min),
故答案为:$\frac{{c}_{0}}{5t}$;
④NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8KJ/mol,反应为放热反应,n(NO2):n(SO2)=1,SO2(g)的起始浓度为c0 mol•L-1,c(NO2)=c0mol/L,
图中C、D两点对应的实验温度分别为Tc和Td,C点二氧化氮转化率为50%,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始量(mol/L) c0 c0 0 0
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡常数K=1
D点二氧化氮转化率40%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0 mol•L-1,c(NO2)=1.5c0mol/L,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始量(mol/L) 1.5c0 c0 0 0
变化量(mol/L) 0.6c0 0.6c0 0.6c0 0.6c0
平衡量(mol/L) 0.9c0 0.4c0 0.6c0 0.6c0
平衡常数K=1
平衡常数相同说明反应温度相同,Tc=Td
故答案为:=.
点评 本题考查了热化学方程式书写和盖斯定律计算、平衡标志、反应速率计算、平衡常数计算等,掌握基础是解题关键,题目难度中等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 | 化学方程式 |
| ① | 将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为橙红色 | Cl2+2NaBr=2NaCl+Br2 |
| ② | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.
2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 治理汽车尾气中NO和CO,可利用催化装置将NO与CO转化成CO2和N2 | |
| C. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ 2CuO CuO+H2SO4═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试纸在检测溶液时不需要湿润,而检测气体时必须湿润 | |
| B. | 焰色反应使用的铂丝通常可用稀硫酸清洗 | |
| C. | 碘水中的碘可以用酒精萃取 | |
| D. | 在实验室遇酸灼伤,用水洗后再用稀NaOH溶液浸洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与过量稀HNO3反应,电子转移数为2NA | |
| B. | 120g由NaHSO4和KHSO3组成的混合物含硫原子数为NA | |
| C. | 标准状况下,22.4LCH2Cl2含氯原子数为2 NA | |
| D. | 0.3mol/LAl(NO3)3溶液中含A13+数小于0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化成金刚石的反应是吸热反应 | |
| C. | △H3=△H1-△H2 | |
| D. | △H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com