
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
【答案】D
【解析】
A. CaO能与水反应,使c(OH-)增大,同时放出大量的热,有利于氨气的逸出,而CaCl2为中性的盐,能够溶于水,热量的变化很小,与水不反应,对氨气的逸出没有作用,A错误;
B. 氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,所以检验三颈瓶集满NH3的方法是将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明 NH3已收满,B错误;
C. 三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,C点压强最小、大气压不变,所以大气压和C点压强差最大,则喷泉越剧烈,C错误;
D. 盐酸显酸性,碳酸氢钠溶液显碱性,氨水溶液显碱性,因此氨气在酸性溶液中的吸收效率高于碱性溶液中的吸收效率,D正确;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
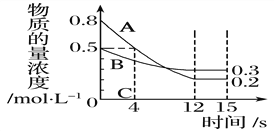
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中进行以下反应:4NH3+5O2=4NO+6H2O,半分钟后冷却至室温,测得NO的物质的量增加了0.3mol,则此反应的平均反应速率υ(X)为( )
A. υ(H2O)=0.12mol·L-1·min-1B. υ(O2)=0.30mol·L-1·min-1
C. υ(NO)=0.008mol·L-1·s-1D. υ(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
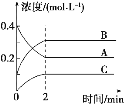
A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述错误的是
①18 g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移电子数为 NA
③常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1 L 0.50 mol·L━1NH4Cl溶液与2 L 0.25mol·L━1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A. ② B. ②④⑤ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。
![]()
下列说法中错误的是( )
A. ①、②中除加试剂外,还需要进行过滤操作
B. 加热蒸干b溶液能得到原溶质
C. ③中需要通入过量的NH3
D. ④进行的操作是加热,而且d一定是Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com