
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
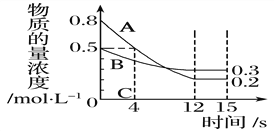
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
【答案】 3A(g)+B(g) ![]() 2C(g) 乙>甲>丙 3~4min 因该反应是放热反应,此时温度高,温度对反应速率占主导作用 AC BC
2C(g) 乙>甲>丙 3~4min 因该反应是放热反应,此时温度高,温度对反应速率占主导作用 AC BC
【解析】(1)经测定前4s内v(C)=0.05 mol·L-1·s-1,生成C是0.05 mol·L-1·s-1×4s=0.2mol/L,此时消耗A是0.8ml/L-0.5mol/L=0.3mol/L,则a:c=3:2;平衡时消耗A与B分别是0.6mol/L,0.2mol/L,则a:b=3:1,所以该反应的化学方程式为3A(g)+B(g)![]() 2C(g);(2)如果都用物质A表示反应速率,则根据反应速率之比是相应的化学计量数之比可知分别是0.3 mol·L-1·s-1、0.36 mol·L-1·s-1、0.24 mol·L-1·s-1,所以甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙。(3)0~1、1~2、2~3、3~4、4~5、5~6 min中生成的氢气体积分别是(mL)50、70、104、168、80、30,因此反应速率最大3~4min,这是由于该反应是放热反应,此时温度高,温度对反应速率占主导作用;(4)A.CH3COONa与氢离子反应生成弱酸醋酸,氢离子浓度降低,反应速率减小,随着反应的进行,氢离子又逐渐电离出来,所以生成的氢气体积几乎不变,A错误;B.加入NaNO3溶液,在酸性溶液中硝酸根具有强氧化性,与金属反应不能得到氢气,B错误;C.KCl溶液相当于稀释,氢离子浓度降低,反应速率减小,且生成的氢气体积不变,C正确;D.Na2CO3溶液消耗氢离子产生二氧化碳,最终生成的氢气体积减少,D错误,答案选AC;(5)A.单位时间内生成n mol H2的同时,生成n mol HI不满足反应速率之比是相应的化学计量数之比,没有达到平衡状态,A错误;B.一个H-H键断裂的同时有两个H-I键断裂满足反应速率之比是相应的化学计量数之比,达到平衡状态,B正确;C.温度和体积一定时,混合气体颜色不再变化说明单质碘的浓度不再发生变化,达到平衡状态,C正确;D.反应速率v(H2)=v(I2)=
2C(g);(2)如果都用物质A表示反应速率,则根据反应速率之比是相应的化学计量数之比可知分别是0.3 mol·L-1·s-1、0.36 mol·L-1·s-1、0.24 mol·L-1·s-1,所以甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙。(3)0~1、1~2、2~3、3~4、4~5、5~6 min中生成的氢气体积分别是(mL)50、70、104、168、80、30,因此反应速率最大3~4min,这是由于该反应是放热反应,此时温度高,温度对反应速率占主导作用;(4)A.CH3COONa与氢离子反应生成弱酸醋酸,氢离子浓度降低,反应速率减小,随着反应的进行,氢离子又逐渐电离出来,所以生成的氢气体积几乎不变,A错误;B.加入NaNO3溶液,在酸性溶液中硝酸根具有强氧化性,与金属反应不能得到氢气,B错误;C.KCl溶液相当于稀释,氢离子浓度降低,反应速率减小,且生成的氢气体积不变,C正确;D.Na2CO3溶液消耗氢离子产生二氧化碳,最终生成的氢气体积减少,D错误,答案选AC;(5)A.单位时间内生成n mol H2的同时,生成n mol HI不满足反应速率之比是相应的化学计量数之比,没有达到平衡状态,A错误;B.一个H-H键断裂的同时有两个H-I键断裂满足反应速率之比是相应的化学计量数之比,达到平衡状态,B正确;C.温度和体积一定时,混合气体颜色不再变化说明单质碘的浓度不再发生变化,达到平衡状态,C正确;D.反应速率v(H2)=v(I2)=![]() v(HI)没有指明反应速率的方向,不能说明反应达到平衡状态,D错误;E.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,E错误;F.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以温度和体积一定时,混合气体的密度不再变化,不能说明反应达到平衡状态,F错误;答案选BC。
v(HI)没有指明反应速率的方向,不能说明反应达到平衡状态,D错误;E.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,E错误;F.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以温度和体积一定时,混合气体的密度不再变化,不能说明反应达到平衡状态,F错误;答案选BC。


科目:高中化学 来源: 题型:
【题目】已知H2SO3+I2+H2O == H2SO4+2HI,将0.1mol Cl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是
A. 物质的还原性:HI>H2SO3>HCl
B. H2SO3的物质的量浓度为0.6 mol·L-1
C. 若再通入0.05mol Cl2,恰好能将HI和H2SO3完全氧化
D. 通入0.1mol Cl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN﹣N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( ) 
A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4 (白磷)高
D.1mo1N4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1 B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1 D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6 是一种优良的绝缘气体,分子结构中只有S─F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F─F 、S─F键需吸收的能量分别为160 kJ、330 kJ。则1 mol 固体硫单质参加:S(s)+3F2(g)=SF6(g)反应,完全生成SF6(g)的热效应为( )
A. 吸收430 kJ B. 释放450 kJ
C. 释放1220 kJ D. 释放1780 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹). 
(1)甲、乙两仪器的名称是、
(2)A、C、E相连后的装置可用于制取Cl2 , 写出A中发生反应的化学方程式 , 将Cl2通入含有酚酞的NaOH溶液中的现象是 , 该反应的离子方程式为 .
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验. ①写出该反应的离子方程式 .
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 , 再打开止水夹 , 使烧杯中的水进入试管丁中.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2 , 直至试管全部充满水,则所得溶液中溶质的物质的量浓度是molL﹣1(保留2位有效数值,气体按标准状况计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去)。试回答:
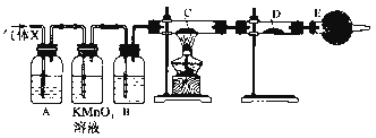
(1)上述反应中生成二氧化硫的化学方程式为__________________。
(2)乙同学认为还可能产生氢气的理由是__________________。
(3)丙同学在安装好装置后,必须首先进行的一步操作是:_________________。
(4)A中加入的试剂可能是________,作用是__________________;
B中加入的试剂可能是________,作用是__________________;
E中加入的试剂可能是________,作用是____________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:________,D中:________。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?________(填“能”或“不能”),原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com