
【题目】利用下面装置设计实验,制备SO2并进行探究。
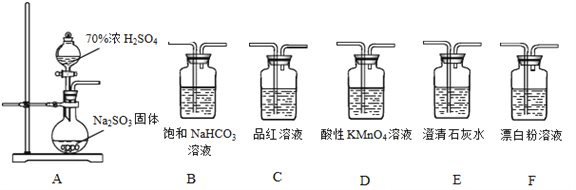
(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。
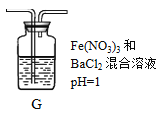
①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2OBaSO43SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊B→D→F (或B→C→F或 B→D→C→F 或 B→C→D→F)
【解析】(1)装置A中反应为制备二氧化硫的反应,化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)二氧化硫通入D中,被硝酸根氧化为硫酸根,3SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+,与钡离子反应生成硫酸钡沉淀,Ba2++SO42-=3BaSO4↓;故答案为:①BaSO4;②3SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+;
(3)二氧化硫应该先通入NaHCO3溶液,将生成的气体通入酸性高锰酸钾中吸收二氧化硫气体后,再将气体通入C品红(DKMnO4溶液),品红不褪色(D高锰酸钾),或者E澄清石灰水,澄清石灰水变浑浊,说明生成二氧化碳气体,证明H2SO3>H2CO3,又酸性:H2SO4>H2SO3,说明H2SO4的酸性强于H2CO3;故答案为:C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊;
(4)要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:应先用二氧化硫制备二氧化碳,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,再用品红检验二氧化硫是否除净,再通入漂白粉中,故顺序为:A→B→D→C→F;故答案为:B→D→C→F。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定要由两种不同的金属组成
D.原电池中发生氧化反应的电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH=CHCl该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性高锰酸钾溶液褪色 ⑥与硝酸银溶液生成白色沉淀 ⑦聚合反应
A. 以上反应均可发生 B. 只有⑦不能发生
C. 只有⑥不能发生 D. 只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl![]() H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1molL-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
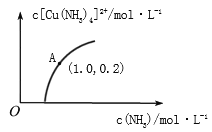
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是

A.Ⅱ为盐酸稀释时pH的变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。

(1)写出浓硫酸与木炭粉在加热条件下的化学方程式______________________。
(2)①中无水硫酸铜的作用是___________________________。
(3)②中酸性KMnO4溶液的作用是__________________________。
(4)②中两次用到品红溶液,它们的作用分别是
A_____________________, B ___________________ 。
(5)③中出现的现象____________________________________________________,
发生反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.正极反应式为Ag++e–═Ag
B.电池放电时Cl–由正极向负极迁移
C.负极反应式为Mg–2e–═Mg2+
D.负极会发生副反应Mg+2H2O═Mg(OH)2+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com