
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是

A.Ⅱ为盐酸稀释时pH的变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、绿矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验。已知:
①SO2+Br2+2H2O→2HBr+H2SO4;②FeS+2HCl→FeCl2+ H2S↑(FeS块状固体难溶于水)
可选用的仪器如图所示:
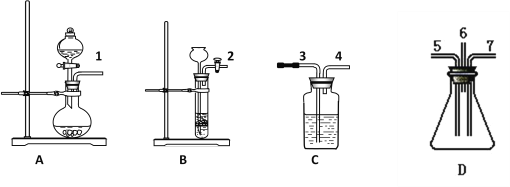
可选用的试剂:
①稀盐酸,②溴水,③Na2SO3粉末状固体,④FeS固体,⑤品红溶液,⑥氢氧化钠溶液,⑦浓硫酸。试回答下列问题:
(1)制取SO2气体选用装置____( 从A——D中选取,填字母),选用的试剂是____和______(从①——⑦中选取,填数字)。
(2) 制取H2S气体选用装置____( 从A——D中选取,填字母),选用的试剂是____和_____(从①——⑦中选取,填数字)。
(3)表现SO2氧化性的实验是上述仪器中的D装置,有关化学方程式是______________________;
表现SO2还原性的实验是上述仪器中的_______装置,能观察到的实验现象是_______________。
(4)为了防止污染空气,从装置D出气口排出的气体要用_____吸收(从①——⑦中选取,填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下面装置设计实验,制备SO2并进行探究。
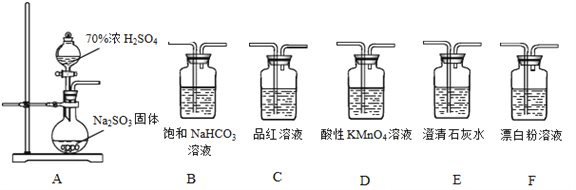
(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。
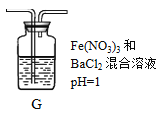
①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大.
A.①④ B.①② C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
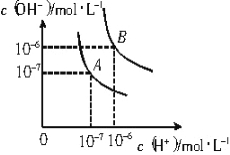
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 。
(2)95℃时,若10体积pH1= a的某强酸溶液与1体积pH2= b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________。
(3)25℃时,将pH = 11的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com