
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大.
A.①④ B.①② C.②③ D.②④
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 热的纯碱溶液可用于去除物品表面的油污
B. 硫酸可用于化肥、医药、农药的生产,金属矿石的处理
C. 硫酸钙可用于医疗上作检查肠胃的内服药剂,即“钡餐”
D. 钠可用于从钛、锆等金属氯化物中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是

A.Ⅱ为盐酸稀释时pH的变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。

(1)写出浓硫酸与木炭粉在加热条件下的化学方程式______________________。
(2)①中无水硫酸铜的作用是___________________________。
(3)②中酸性KMnO4溶液的作用是__________________________。
(4)②中两次用到品红溶液,它们的作用分别是
A_____________________, B ___________________ 。
(5)③中出现的现象____________________________________________________,
发生反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存
B. H2O2的电子式是:![]()
C. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 铁锈是化合物,可用Fe2O3·nH2O(2<n<3)表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属冶炼的反应原理,不正确的是
A.2NaCl(熔融)![]() 2Na+Cl2↑ B.MgO+H2
2Na+Cl2↑ B.MgO+H2![]() Mg+H2O
Mg+H2O
C.Fe2O3+3CO![]() 2Fe+3CO2 D.2Ag2O
2Fe+3CO2 D.2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
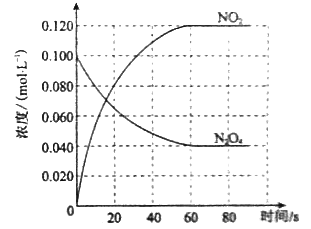
回答下列问题:
(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 molL-1s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
a:T 100℃(填“大于”或“小于”),判断理由是 。
b:列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com