
【题目】已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转化关系:A ![]() B
B ![]() C
C
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体.则A的空间构型为 , A转化为B反应的化学方程式为 .
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为 , B的电子式为 .
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为 . 氯碱工业中阴极的电极反应式为 .
【答案】
(1)三角锥形;4NH3+5O2 ![]() ?4NO+6H2O
?4NO+6H2O
(2)Cu2O;![]()
(3)[Al(OH)4]﹣;2H++2e﹣=H2↑或2H2O+2 e﹣=H2↑+2OH﹣
【解析】解:(1)若A为能使湿润的红色石蕊试纸变蓝的气体,则A为NH3 , 红棕色气体C为NO2 , D为氧气,B为NO,该过程为氨气的连续氧化反应,NH3为三角锥形结构,A转化为B反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O, 所以答案是:三角锥形;4NH3+5O2
4NO+6H2O, 所以答案是:三角锥形;4NH3+5O2 ![]() 4NO+6H2O;(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,A为Cu2O,D是一种黑色固态非金属单质,则D为C,B是CO2 , C是CO,二氧化碳的电子式为:
4NO+6H2O;(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,A为Cu2O,D是一种黑色固态非金属单质,则D为C,B是CO2 , C是CO,二氧化碳的电子式为: ![]() ,
,
所以答案是:Cu2O; ![]() ;(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,A是NaOH,B为Al(OH)3 , A是Al3+ , C是[Al(OH)4]﹣ , 氯碱工业中阴极的电极反应式为:2H++2e﹣=H2↑或2H2O+2 e﹣=H2↑+2OH﹣ ,
;(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,A是NaOH,B为Al(OH)3 , A是Al3+ , C是[Al(OH)4]﹣ , 氯碱工业中阴极的电极反应式为:2H++2e﹣=H2↑或2H2O+2 e﹣=H2↑+2OH﹣ ,
所以答案是:[Al(OH)4]﹣;2H++2e﹣=H2↑或2H2O+2 e﹣=H2↑+2OH﹣ .


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( ) 
A.图中的两条曲线,X表示NO2浓度随时间的变化曲线
B.前10 min内用v(N2O4)=0.02 mol/(Lmin)
C.25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L
D.该温度下反应的平衡常数 K=1.11 L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有K2CO3 , 产生的气体中含有CO、CO2 . 请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:①蒸馏水 ②3%H2O2溶液 ③氧化铜 ④1.0 molL﹣1盐酸⑤浓硫酸⑥1.0 molL﹣1NaOH溶液 ⑦澄清石灰水 ⑧0.5 molL﹣1 CuSO4溶液 ⑨2%KSCN溶液 ⑩苯酚溶液
(1)若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内)
(2)提出合理假设假设1:只有Fe; 假设2:只有FeO; 假设3: .
(3)设计实验方案并实验验证步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体.
步骤2:取少量上述不溶固体放入试管中,加入足量溶液,充分振荡.若固体无明显变化,则假设成立;若有暗红色固体生成,则反应的离子方程式为 .
步骤3:取步骤2所得暗红色固体于试管中,滴加过量 , 振荡后静置.若溶液基本无色,则假设成立;若溶液呈 , 则假设3成立.
(4)问题讨论若固体产物中FeO含量较少,用步骤3方法难以确定.请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论): .
(5)拓展与延伸有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”.假设溶液中的+3价铁还能被氯水氧化为更高价的QUOTE,试写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | 硫酸 | 纯碱 | 石膏 | 铁红 |
B | 氢硫酸 | 烧碱 | 纯碱 | 生石灰 |
C | 碳酸 | 熟石膏 | 小苏打 | 二氧化硫 |
D | 二氧化碳 | 苛性钾 | 食盐 | 石灰石 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
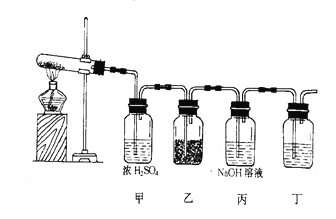
(1)写出各物质的化学式:
A______; B_______; C________; D______; E_______; F___________。
(2)写出试管中及丙瓶中反应的化学方程式:_______________;__________________。
(3)等物质的量A、B分别与足量的盐酸反应生成气体的体积________(填“一样多”、“前者多”、“后者多”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3
D.相对分子质量Na2CO3<NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+O2 ![]() 2SO3 , 达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
2SO3 , 达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
A.0.6 mol
B.0.4 mol
C.0.8 mol
D.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出).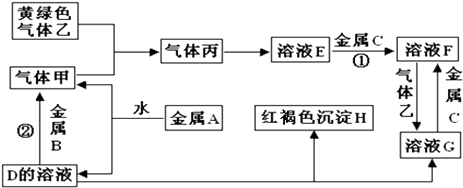
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A;H; G;乙;
(2)写出下列反应的化学方程式反应①反应② .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com