
| A | ||||||||||||||||||
| M | B | D | ||||||||||||||||
| G | H | Q | R | |||||||||||||||
| E | ||||||||||||||||||


 ,故答案为:第三周期ⅥA族;
,故答案为:第三周期ⅥA族; ;
;

 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
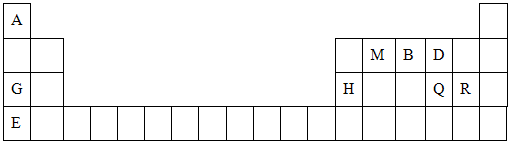
(10分)元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
(1)Q元素在元素周期表中的位置 ,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其MD2分子的结构式: 。
(4) 用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
查看答案和解析>>
科目:高中化学 来源:2010-2011学年上海市闸北区高三上学期期末考试化学试卷 题型:填空题
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
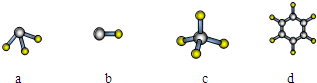
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省高一第二学期期末复习化学试卷1 题型:填空题
(10分)元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
(1)Q元素在元素周期表中的位置 ,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其MD2分子的结构式: 。
(4) 用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com