
下列叙述正确的是 ( )
A.碳的摩尔质量为12g
B.1mol NaCl的质量是58.5g/mol
C.58.5g NaCl所含Na+和Cl-共1mol
D.1mol NaCl约含6.02×1023个Cl-
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
下列依据相关数据作出的推理和判断中,不正确的是 ( )
A依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低
B.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯
C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等
D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1mol某有机物含碳原子n mol,在恰好完全燃烧时只生成CO2和H2O,耗氧气1.5n mol,则对该有机物的说法正确的是( )
①该有机物分子可能含2个氧原子
②该有机物可能使溴的四氯化碳溶液褪色
③若该有机物能与金属钠反应,则分子中的碳氢关系符合CnH2n+2
④若该有机物不能与金属钠反应,则分子中的碳氢关系一定符合CnH2n
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数相同
B.2 g H2所含的原子数目为NA
C.在常温常压下,11.2 L N2所含的原子数为NA
D.17 g NH3所含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0 g NaOH固体溶于水配成100mL溶液,其密度为
0.20g/mL。
(1)该溶液中NaOH 的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为 ,含NaOH的质量为 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分离方法不正确的是 ( )
A.用过滤的方法除去食盐水中的泥沙 B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘 D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.22.4 L氢气中含有2NA个氢原子
B.14 g氮气中含NA个氮原子
C.2L 0.30mol/L Na2SO4溶液中所含0.6NA个Na+
D.标准状况下,含有NA个氧原子的臭氧(O3)体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3;物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
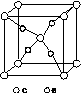
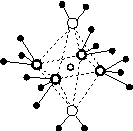
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。
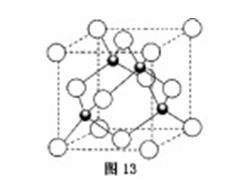
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com