
某含结晶水的物质,化学式为A·nH2O,A的相对分子质量为m。如果加热a g该化合物,直至结晶水全部失去。剩余残渣为b g,则n的计算关系式是
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
 (2012?唐山二模)【化学--选修物质结构与性质】
(2012?唐山二模)【化学--选修物质结构与性质】



查看答案和解析>>
科目:高中化学 来源: 题型:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
| 0.418×2.35 |
| 0.025 |
| 0.418×2.35 |
| 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
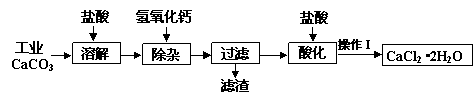
科目:高中化学 来源: 题型:解答题
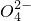 、Cl-等杂质______;
、Cl-等杂质______;| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com