
【题目】氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1)已知断裂下列化学键需要吸收的能量分别为:![]() ,
,![]() ,
,![]() ,写出以N2和H2为原料合成NH3的热化学方程式______。
,写出以N2和H2为原料合成NH3的热化学方程式______。
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图 所示:
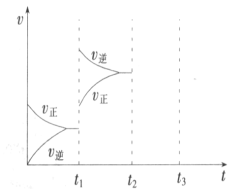
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像_____________。
【答案】N2(g)+3H2(g)![]() 2NH3(g) △H= -90.8 kJ·mol-1 升高温度
2NH3(g) △H= -90.8 kJ·mol-1 升高温度 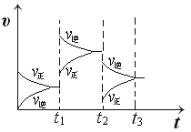
【解析】
(1)根据反应热△H=反应物总键能-生成物总键能计算;
(2)①t1时刻改变的条件后正逆反应速率都增大,平衡逆移;②t2恒压充入氦气,体积膨胀,参加反应的气体所占分压减小,平衡向体积增大方向移动,据此画出图象。
(1)N2和H2为原料合成NH3的反应为N2(g)+3H2(g)2NH3(g)△H=反应物总键能-生成物总键能=946.0kJmol-1+3×436.0kJmol-1-6×390.8kJmol-1=-90.8 kJmol-1;故答案为:N2(g)+3H2(g)2NH3(g)△H=-90.8 kJmol-1;
(2)①t1时刻改变的条件后正逆反应速率都增大,逆反应速率大于正反应速率,平衡逆移,所以改变条件为升高温度,故答案为:升高温度;
②t2恒压充入氦气,体积膨胀,各反应物质浓度减小,参加反应的气体所占分压减小,平衡向体积增大方向移动,正逆反应速率都减小,画出图象为: ,故答案为:
,故答案为: 。
。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】可燃冰是另一种CH4的重要来源,利用可燃冰制备的甲烷可以设计成如下燃料电池,可以作为“移动的发电厂”,源源不断的对外供电,下列说法错误的是

A.a电极通入甲烷气体,作负极
B.每通入1mol CH4,有8mol e-通过质子交换膜
C.b电极的电极反应式为:O2+4e-+4H+=2H2O
D.催化剂电极采用疏松多孔结构可提高电极反应效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2.0gH218O与2H2O的混合物中所含中子数约为6.02×1023
B.2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,说明该反应的△H<0
C.向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
D.向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清,说明苯酚的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
A. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
4NO(g)+6H2O(g)ΔH=-akJ·mol-1
B. N2(g)+3H2(g)![]() 2NH3(g)ΔH=-bkJ·mol-1
2NH3(g)ΔH=-bkJ·mol-1
C. 2SO3(g)![]() 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
2SO2(g)+O2(g)ΔH=+ckJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
4NO2(g)+O2(g)ΔH=+dkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:![]()
已知转化过程中的反应为2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g
C. 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:
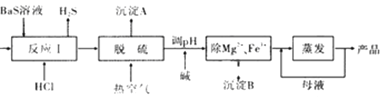
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol![]() 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol![]() H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ B(g)![]() C(g) +2D(g)的能量变化如图所示,回答下列问题。
C(g) +2D(g)的能量变化如图所示,回答下列问题。

(1)该反应是_______________反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”“减小”“不变”下同),原因是__________________;
(3)向体系中加入催化剂,△H_____________;
(4)向体系中加入催化剂,反应速率增大,E1和E2的变化是E1______E2_____ ;
(5)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为___________平衡常数K=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、C12反应合成氯化亚砜。发生如下反应:
①C12(g)+SO2(g)![]() SO2C12(g) △H=-471.7kJ·mol-1
SO2C12(g) △H=-471.7kJ·mol-1
②SO2C12(g)+SCl2(g)![]() 2SOC12(g)△H=-5.6kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1
567K时,在10L密闭容器中,充入一定量的C12、SO2和SCl2,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化(反应达到平衡时的温度与初始温度相同)如下图所示,起始各组分及达平衡时SO2C12(g)的物质的量如下表。

(1)0~1min,图中数据显示体系压强增大的原因是________________。
(2)0~4min内,v(C12)=_____mol·L-1·min-1,5min时SCl2的转化率为________。
(3)567K时,上述反应②的KP______。
(4)567K下,若扩大容器体积为20L,则平衡时c(SO2)_____(填“大于”“小于”或“等于”)上述反应平衡时的c(SO2)。
II.Li/SOCl2电池是一种高比能量电池,电解液为非水的LiAlC14的SOCl2溶液。正极为金属酞菁配合物(M-Pe,电池正极催化剂)附着的碳棒。正极催化过程为:SOCl2先与酞菁形成加合物,接着发生加合物的两步快速的电子转移,过程如图所示。

(5)上述正极催化过程M-PeSOCl2为_______(填“催化剂”或“中间产物”),放电过程中每转移1mol电子生成_____g硫单质。电池总反应的化学方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
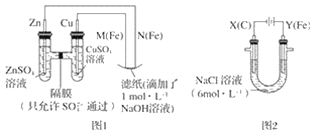
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com