某化学课外小组设计了如下图所示的装置,进行氨气性质实验.利用图1完成氨的催化氧化实验,其中箭头表示气体流向,A、B表示两种纯净、干燥的气体,反应进行一段时间后,装置已中有红棕色气体生成.实验中所用的药品和干燥剂只能从下列物质中选取KMnO
4、Na
2O
2、NH
4Cl、NH
4HCO
3、P
2O
5、碱石灰、生石灰、蒸馏水、浓硫酸、浓氨水
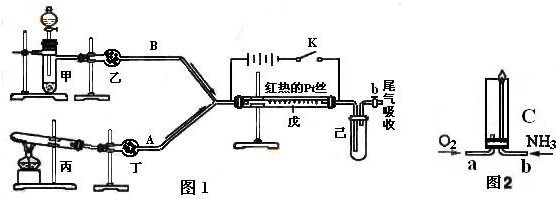
根据图1中装置和反应现象请回答:
(1)若乙中盛有P
2O
5,此时丙装置中发生反应的化学方程式为
.若丁中盛有P
2O
5,此时甲装置中应选择的试剂是
浓氨水和生石灰(或碱石灰)
浓氨水和生石灰(或碱石灰)
.
(2)检验甲装置气密性的方法
关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好
关闭分液漏斗的活塞,将试管中的导管口浸没在水槽中的液面以下,双手紧贴试管外壁,导管口有气泡冒出,松开手后,导管内形成一段水柱,证明装置的气密性良好
.
(3)当己中充满红棕色气体后,停止甲、丙装置中的反应,并关闭a、b两个活塞,将己装置浸入冰水中,出现的现象是
气体颜色变浅
气体颜色变浅
简述产生此现象的原因
2NO2?N2O4,正反应属于放热反应,达到平衡后,降低温度,平衡向右移动,NO2浓度减小,所以气体颜色变浅
2NO2?N2O4,正反应属于放热反应,达到平衡后,降低温度,平衡向右移动,NO2浓度减小,所以气体颜色变浅
,若将己装置中的试管倒置于盛有水的水槽中,发生的现象是
红棕色气体变为无色,试管内液面上升
红棕色气体变为无色,试管内液面上升
.
(4)已知氨气在纯氧中安静的燃烧,如图2,将过量O
2与NH
3分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气.先通入O
2,后通过NH
3的理由是
氨气在空气中不能点燃,逸出造成污染
氨气在空气中不能点燃,逸出造成污染
.
(5)液氨与水性质颇为相似,其电离方程式可表示为:2NH
3?NH
4++NH
2-.某温度下其离子积常数为1×10
-30(mol?L
-1)
2.液氨中的pNH
4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡
向正方向
向正方向
移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH
4=
29
29
.

 步步高达标卷系列答案
步步高达标卷系列答案 钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.
钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.