
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 钢笔使用不同牌子的墨水堵塞 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 | |
| D. | 向石灰水中通入二氧化碳气体产生白色浑浊 |
分析 A.豆浆属于胶体分散系;
B.墨水是胶体;
C.蛋白质溶液是胶体,胶体能产生丁达尔效应;
D.氢氧化钙与二氧化碳反应生成碳酸钙沉淀.
解答 解:A.豆浆属于胶体分散系,盐卤属于电解质,豆浆中加入盐卤做豆腐是利用胶体遇电解质发生聚沉的性质,与胶体有关,故A正确;
B.带相反电荷的胶体混合发生聚沉,故B正确;
C.蛋白质溶液是胶体,胶体能产生丁达尔效应,所以与胶体有关,故C正确;
D.氢氧化钙与二氧化碳反应生成碳酸钙沉淀,与胶体无关,故D错误.
故选D.
点评 本题考查胶体的性质,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等,利用胶体性质对生产生活中实际问题进行解释,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4 L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
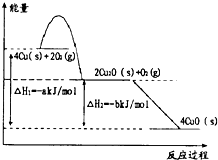 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. |  向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. |  将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.00 | B. | 63.60 | C. | 64.00 | D. | 65.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
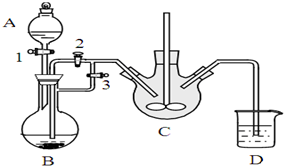 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )| A. | 苯和氢气 | B. | 稀硫酸与一氧化碳 | ||
| C. | 饱和食盐水与氯气 | D. | 浓溴水和乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com