
【题目】某种苯的同系物0.1mol 在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1②1∶1∶2∶6③3∶2④3∶2∶2∶2∶1,请分别推断出其对应的结构:①_______;②_________________;③___________;④___________。
【答案】![]()

![]()
![]()
【解析】
浓硫酸增重9g,为H2O的质量,氢氧化钠溶液增重35.2g,为CO2的质量,据此计算判断该有机物的分子式,根据核磁共振氢谱可知有几种性质不同的H,据此确定有机物的结构简式。
浓硫酸增重9g,为H2O的质量,则n(H)=2×![]() =1mol,氢氧化钠溶液增重35.2g,为CO2的质量,则n(C)=
=1mol,氢氧化钠溶液增重35.2g,为CO2的质量,则n(C)=![]() =0.8mol,所以1mol有机物中含有8molC,10molH,所以该苯的同系物的分子式为C8H10。
=0.8mol,所以1mol有机物中含有8molC,10molH,所以该苯的同系物的分子式为C8H10。
①在PMR谱上峰给出的稳定强度为3∶1∶1,即有3种类型的氢原子,个数之比是3∶1∶1,则为邻二甲苯,结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
②在PMR谱上峰给出的稳定强度为1∶1∶2∶6,即有4种类型的氢原子,个数之比是1∶1∶2∶6,则为间二甲苯,结构简式为 ,故答案为:
,故答案为: ;
;
③在PMR谱上峰给出的稳定强度为3∶2,即有2种类型的氢原子,个数之比是3∶2,则为对二甲苯,结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
④在PMR谱上峰给出的稳定强度为3∶2∶2∶2∶1,即有5种类型的氢原子,个数之比是3∶2∶2∶2∶1,则为乙苯,结构简式为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 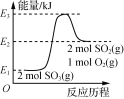 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B. 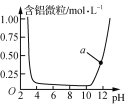 表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
C. 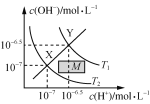 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D. 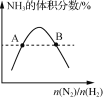 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
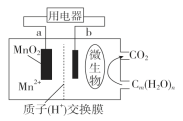
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)某有机物的结构简式如图所示,关于该有机物的说法不正确的是
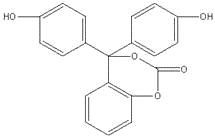
A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
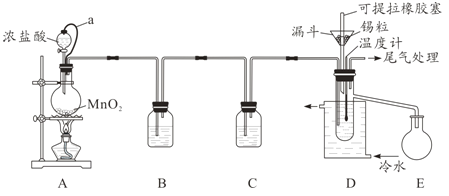
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
(4)尾气处理时,可选用的装置是__________(填序号)。
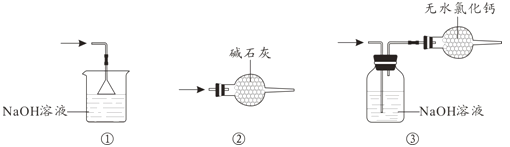
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在四支相同的试管中,分别装入等物质的量混合的两种气体。混合气体具体组成如下:
试管编号 | 1 | 2 | 3 | 4 |
混合气体组成 | Cl2、SO2 | NO2、O2 | NO、O2 | NH3、N2 |
将四支试管迅速同时倒立于水槽中,至液面稳定后,水面上升高度由大到小正确的是( )
A.1>2>3>4B.3>1>4>2
C.4>2>3>1D.1>3>2>4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com