
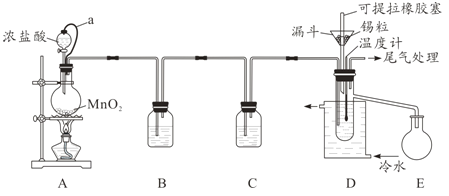
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
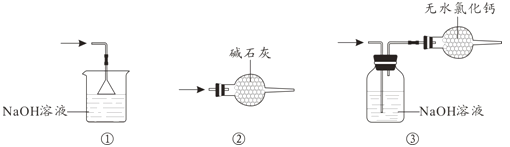
(4)尾气处理时,可选用的装置是__________(填序号)。
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
【答案】平衡压强使浓盐酸顺利流下 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 避免SnCl4挥发 ② 常温下,CuCl2为固体且密度比SnCl4大 85%
Mn2++Cl2↑+2H2O 避免SnCl4挥发 ② 常温下,CuCl2为固体且密度比SnCl4大 85%
【解析】
根据装置:A装置制备氯气:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,其中a可以平衡压强,使浓盐酸顺利流下,B吸收杂质HCl气体,C吸收水蒸气,干燥纯净的Cl2与Sn在D中反应制得SnCl4,锡粒中含铜杂质使得D中产生的SnCl4中含有CuCl2,但因为CuCl2熔点高,为固体,且密度比SnCl4大,不会随SnCl4液体溢出,E收集SnCl4液体,尾气用盛放碱石灰的干燥管处理,据此分析作答。
Mn2++Cl2↑+2H2O,其中a可以平衡压强,使浓盐酸顺利流下,B吸收杂质HCl气体,C吸收水蒸气,干燥纯净的Cl2与Sn在D中反应制得SnCl4,锡粒中含铜杂质使得D中产生的SnCl4中含有CuCl2,但因为CuCl2熔点高,为固体,且密度比SnCl4大,不会随SnCl4液体溢出,E收集SnCl4液体,尾气用盛放碱石灰的干燥管处理,据此分析作答。
(1)a管的作用是平衡浓盐酸上下的气体压强,使浓盐酸顺利流下;
(2)A中浓盐酸与MnO2混合加热制取Cl2,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)在D中制取的物质SnCl4中含有杂质CuCl2,SnCl4易挥发,所以D中冷却水的作用是避免SnCl4挥发;
(4)尾气中含有氯气会导致大气污染,因此一定要进行处理,可根据Cl2与碱反应的性质,用碱性物质吸收,同时为防止SnCl4水解,该装置还具有干燥的作用,用盛放碱石灰的干燥管可满足上述两个条件,故合理选项是②;
(5)锡粒中含铜杂质致D中产生CuCl2,但因为常温下,CuCl2为固体且密度比SnCl4大,故不影响E中产品的纯度;
(6)滴定中,铁元素化合价由+2价变为+3价,升高1价,Cr元素化合价由+6价变为+3价,降低3价,则有关系式:3SnCl2~6Fe2+~K2Cr2O7,n(SnCl2)=3n(K2Cr2O7) =3×0.1000mol/L×0.02L=0.006mol,故SnCl4产品的纯度为![]() ×100%=85%。
×100%=85%。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(s)+Y(g) W(g)+Z(g)△H>0,在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(υ)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )
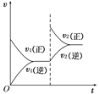
A.增加了X的物质的量B.降低了温度
C.增大了压强D.增大了Y的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车用汽油的抗爆剂约含 17%的 1,2一二溴乙烷。某学习小组用下图所示装置制备少量 1,2 一二溴乙烷,具体流秳如下: 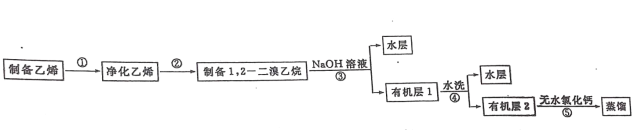
已知:1,2 一二溴乙烷的沸点为131℃,熔点为9.3℃。Ⅰ1,2 一二溴乙烷的制备步聚①、②的实验装置为:

实验步骤:
(ⅰ)在冰水冷却下,将 24mL 浓硫酸慢慢注入12mL乙醇中混合均匀。
(ⅱ)向 D 装置的试管中加入3.0mL 液溴(0.10mol),然后加入适量水液封,幵向烧杯中加入冷却剂。
(ⅲ)连接仪器并检验气密性。向三口烧瓶中加入碎瓷片,通过滴液漏斗滴入一部分浓硫酸与乙醇的混合物,一部分留在滴液漏斗中。
(ⅳ)先切断瓶C与瓶D的连接处,加热三口瓶,待温度上升到约120℃,连接瓶 C与瓶D,待温度升高到180~200℃,通过滴液漏斗慢慢滴入混合液。
(V)继续加热三口烧瓶,待D装置中试管内的颜色完全褪去,切断瓶C与瓶D的连接处,再停止加热。回答下列问题:
(1)图中 B 装置玻璃管的作用为__________________________________________。
(2)(ⅳ)中“先切断瓶C与瓶D的连接处,再加热三口瓶”的原因是__________________________________________。
(3)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为__________________________________________。
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ1,2 一二溴乙烷的纯化
步骤③:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤④:用水洗至中性。
步骤⑤:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集
130~132℃的馏分,得到产品5.64g。
(4)步骤③中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为__________________________________________。
(5)步骤⑤中加入无水氯化钙的作用为_________________________。该实验所得产品的产率为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种苯的同系物0.1mol 在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1②1∶1∶2∶6③3∶2④3∶2∶2∶2∶1,请分别推断出其对应的结构:①_______;②_________________;③___________;④___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E,D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。
(1)C 离子的结构示意图为_______ 。D 在周期表中位置 ______________。
(2)写出 E 的电子式:______________ 。
(3)A、D 两元素形成的化合物属 ______________(填“离子”或“共价”)化合物。
(4)写出 D 的最高价氧化物的水化物和 A 单质反应的化学方程式:_______ 。
(5)B 原子与氢原子形成的粒子中,与 NH3 具有相同电子数的阴离子为______________(填化学式),这种阴离子的电子式为______________ 。
(6)A、D 两元素形成的某化合物具有与 CO2 相似的结构,试用电子式表示其形成过程__________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由两种气态烃组成,取标况下![]() 该混合气体完全燃烧后得到
该混合气体完全燃烧后得到![]() 二氧化碳
二氧化碳![]() 气体已折算为标准状况
气体已折算为标准状况![]() 和10.8g水,则这两种气体可能是
和10.8g水,则这两种气体可能是
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.
C.![]() 和
和![]() D.
D.![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3mol·L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
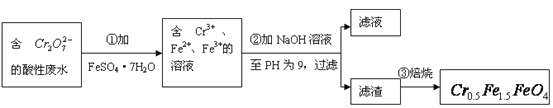
(1)第①步反应的离子方程式是_________________________________________________;
(2)第②步中用pH试纸测定溶液pH的操作是:
______________________________________________________________________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______________________;
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入__________g FeSO4·7H2O。
。理论上需要加入__________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
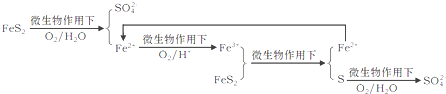
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com