
【题目】某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.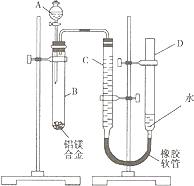
(1)A中试剂为 .
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是 .
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性.上述操作的顺序是(填序号);记录C的液面位置时,除视线平视外,还应 .
(4)B中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为 .
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将(填“偏大”、“偏小”、“不受影响”).
【答案】
(1)NaOH溶液
(2)除去铝镁合金表面的氧化膜
(3)⑤①④③②;
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(5)![]()
(6)偏小
【解析】解:(1)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定铝镁合金中铝的质量分数,应选择NaOH溶液,所以答案是:NaOH溶液;(2)铝镁的表面都容易形成一层氧化膜,在实验前必须除去,所以答案是:除去铝镁合金表面的氧化膜;(3)实验时首先要检查气密性,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,所以答案是:⑤①④③②;使D和C的液面相平;(4)B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(5)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a﹣c)g,设铝的相对原子质量为M,则2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a﹣c)g bml
解之得:M= ![]() ,所以答案是:
,所以答案是: ![]() ;(6)铝的质量分数为:
;(6)铝的质量分数为: ![]() ,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
所以答案是:偏小.
【考点精析】根据题目的已知条件,利用铝的化学性质的相关知识可以得到问题的答案,需要掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】为了除去氯化铝酸性溶液中的Fe3+ , 可在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量盐酸.这种试剂是( )
A.氨水
B.氧化铝
C.氢氧化钠
D.氢氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电化学知识回答下列问题:
(1)如图所示,在不同的电解质溶液中可以组成不同的电池。

①当电解质溶液为稀硫酸时,Fe电极是________(填“正”或“负”)极,其电极反应式为__________。
②当电解质溶液为NaOH溶液时,Al电极是________(填“正”或“负”) 极,其电极反应式为_________。
③若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是______(填“正”或“负”)极,其电极反应式为_______________________________。
(2)请你利用原电池原理,设计实验,比较铜和银的金属活动性。画出实验装置图,标出正负极、电子流动方向。________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
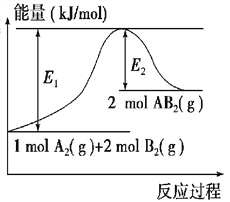
A. 该反应的进行一定需要加热
B. 该反应的ΔH=-(E1-E2) kJ/mol
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 断裂1 mol A—A键和2 mol B—B键放出E1 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是________;表示反应中和热ΔH=-57.3 kJ·mol-1的是________(填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+![]() O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | a | 360 | 500 | 434 |
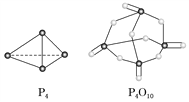
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=________(保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
A | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
C | H2 | CO2 | 通过盛NaOH溶液的洗气瓶 |
D | H2 | O2 | 通过灼热Cu粉 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水一般是用少量的氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制
A. Na2SO4 B. NaCl C. AgNO3 D. KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.金属钠、镁着火时可用泡沫灭火器扑灭
B.为防止试管破裂,加热固体时试管口一般要略高于试管底
C.1L pH=13的Ba(OH)2溶液中含有0.2NA个OH﹣ 离子
D.1.2克CH4所含有的共价键数与0.1 mol NH3所含的共价键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com