
【题目】请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是________;表示反应中和热ΔH=-57.3 kJ·mol-1的是________(填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+![]() O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | a | 360 | 500 | 434 |
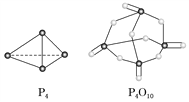
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=________(保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:_______________________________。
【答案】 ΔH3 ΔH5 196 小于 < S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol
【解析】I.考查中和热和燃烧热的定义、反应热的计算,(1)根据燃烧热的定义:1mol可燃气体完全燃烧生成稳定的氧化物放出的热量,即属于燃烧热的是△H3;根据中和热的定义:酸与碱反应生成1mol水时放出的热量,即属于中和热的是△H5;(2)根据△H等于反应物键能总和-生成物键能总和,△H=(6×a+5×500-12×360-4×434)=-2378kJ·mol-1,解得a=196kJ·mol-1;II.考查化学能与热能的转化,(3)因为△H<0,说明此反应是放热反应,即反应物的总能量大于生成物的总能量,即反应生成物的总能量小于反应物的能量总和;(4)液态水转化成水蒸气需要吸收热量,因此2mol氢气完全燃烧生辰水蒸气,放出的热量<572kJ;III.考查热化学反应方程式的书写,(5)1molS完全燃烧放出的热量是![]() kJ=296.8kJ,因此硫燃烧热的热化学方程式为 S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1; (6)NO2和CO反应的化学方程式为:NO2+CO=CO2+NO,根据能量与过程的图像,则热化学反应方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
kJ=296.8kJ,因此硫燃烧热的热化学方程式为 S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1; (6)NO2和CO反应的化学方程式为:NO2+CO=CO2+NO,根据能量与过程的图像,则热化学反应方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是
A. NaHCO3===Na++H++CO32- B. NaHSO4===Na++H++SO42-
C. MgCl2===Mg2++2Cl- D. Ba(OH)2===Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的氯化物溶液10mL,其浓度为0.05mol/L,能恰好与0.1mol/L的 AgNO3溶液15mL完全反应,则R氯化物的化学式为
A. RCl B. RCl2 C. RCl3 D. RCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W和N均是由短周期元素组成的五种化合物.已知五种化合物水溶液的焰色反应均呈黄色,Y、Z和N均由三种元素组成.请根据题目要求回答下列问题.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有(填序号).
A.离子键
B.极性共价键
C.非极性共价键
D.氢键
(2)写出X与二氧化碳反应的化学方程式 .
(3)下表为Y与Z实验的部分内容:
序号 | 主要实验步骤及实验现象 |
① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
写出Y与稀硫酸反应的离子方程式 .
(4)写出含0.1mol Z的溶液与20mL 5molL﹣1的盐酸反应的离子反应式 . 实验③加热蒸发、灼烧得到的最终产物主要是 .
(5)化合物W和N可以相互转化:W ![]() N.若有W和NxH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为 , NxH2O的化学式为 .
N.若有W和NxH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为 , NxH2O的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.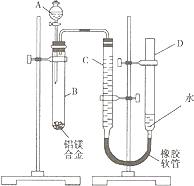
(1)A中试剂为 .
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是 .
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性.上述操作的顺序是(填序号);记录C的液面位置时,除视线平视外,还应 .
(4)B中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为 .
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将(填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成1mo1NH3(g)过程中能量变化示意图,

请写出N2和H2反应的热化学方程式:_____________________________;
(2)若已知下列数据:
化学键 | H-H | N≡N |
键能/kJmol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能______kJmol-1
(3)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式________________________________;
(4)已知1克氢气完全燃烧生成液态水时放出akJ的热量,请写出表示氢气燃烧热的热化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式;所得溶液的pH7(填“>”、“<”或“=”),用离子方程式表示其原因;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/l,则c(SO ![]() )=;
)=;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com