
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氯气和消石灰反应可以制得漂粉精 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用氧化钠作为呼吸面具和潜水艇的供氧剂 |
分析 A、根据明矾净水的原理是氢氧化铝净水来分析;
B、氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水;
C、根据氧化铝的物理性质来分析其应用;
D、氧化钠与水反应生成氢氧化钠,而过氧化钠与水和二氧化碳反应生成氧气;
解答 解:A、明矾净水的原理是:Al3++3H2O=Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水,故A正确;
B、氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水,而Ca(ClO)2是漂粉精,故B正确;
C、氧化铝的熔点很高,可用于制作耐高温材料,故C正确;
D、氧化钠与水反应生成氢氧化钠,而过氧化钠与水和二氧化碳反应生成氧气,所以过氧化钠作为呼吸面具和潜水艇的供氧剂,故D错误;
故选D.
点评 本题考查了盐类水解、氧化铝的物理性质、氯及其化合物的性质、过氧化钠与氧化钠的性质的应用,综合性强,但比较容易.


科目:高中化学 来源: 题型:解答题
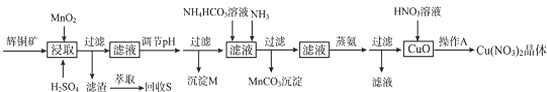
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3、CO2均为酸性氧化物 | |
| B. | 稀豆浆、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 氨水、漂白粉、氢氟酸、小苏打均为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物Y(XO3)2 | B. | 离子化合物Y2X3 | C. | 共价化合物Y3X2 | D. | 共价化合物XY2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com