
科目: 来源:专项题 题型:单选题
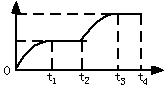
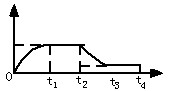
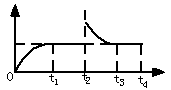
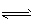 2NH3在t1时刻达到平衡, t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4时刻。在0~t4时间内混合气体中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是
2NH3在t1时刻达到平衡, t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4时刻。在0~t4时间内混合气体中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是 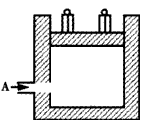
[ ]

查看答案和解析>>
科目: 来源:专项题 题型:单选题
 bR(g) 下图是温度和压强对该反应的影响,其中压强P1<P2,由此可以判断
bR(g) 下图是温度和压强对该反应的影响,其中压强P1<P2,由此可以判断 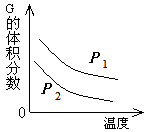
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是 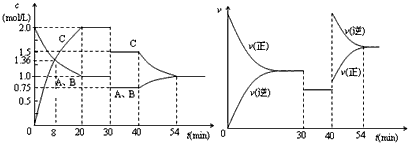
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
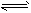 2NO2(g);△H= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
查看答案和解析>>
科目: 来源:专项题 题型:填空题
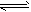 FeO(s)+CO(g) △H1=a kJ/mol;②CO(g)+1/2O2(g)
FeO(s)+CO(g) △H1=a kJ/mol;②CO(g)+1/2O2(g)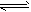 CO2(g) △H2=b kJ/mol 测得在不同温度下,反应①的平衡常数K值随温度的变化如下
CO2(g) △H2=b kJ/mol 测得在不同温度下,反应①的平衡常数K值随温度的变化如下
 为混合物中CO含量,T为温度且T1> T2)
为混合物中CO含量,T为温度且T1> T2) 
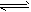 2FeO(s) △H3,该反应的△H3=____kJ/mol。
2FeO(s) △H3,该反应的△H3=____kJ/mol。 查看答案和解析>>
科目: 来源:专项题 题型:填空题
 2C3 (g)△H= -Q1kJ·mol-1(Q1>0),在-个有催化剂的固定容积的容器中加入2mol A和1mol B2,在500℃时充分反应,达平衡后C3的浓度为ωmol·L-1,放出热量Q2kJ。
2C3 (g)△H= -Q1kJ·mol-1(Q1>0),在-个有催化剂的固定容积的容器中加入2mol A和1mol B2,在500℃时充分反应,达平衡后C3的浓度为ωmol·L-1,放出热量Q2kJ。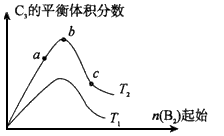
查看答案和解析>>
科目: 来源:专项题 题型:填空题
 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示 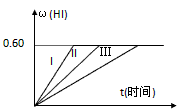
查看答案和解析>>
科目: 来源:专项题 题型:填空题
 CO(g)+H2(g) △H=+131.3kJ.mol-1, △S=+133.7 J·(K·mol)-1。
CO(g)+H2(g) △H=+131.3kJ.mol-1, △S=+133.7 J·(K·mol)-1。 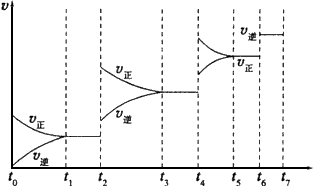
查看答案和解析>>
科目: 来源:专项题 题型:填空题
 O2+HbCO,导致人体缺氧。某实验室模拟研究上述过程。
O2+HbCO,导致人体缺氧。某实验室模拟研究上述过程。
(1)0~3 s间用HbO2表示的平均反应速率为___________;第9 s时HbCO的浓度为 __________,根据曲线Ⅱ计算反应CO+HbO2 O2+HbCO的平衡常数的值为____________。
O2+HbCO的平衡常数的值为____________。
(2) HbCO的浓度超过HbO2浓度的1倍,就会有重度一氧化碳中毒的症状。下列有关一氧化碳中毒的说法错误的是________。
A.人体吸入的CO越多,与血红蛋白结合的O2越少
B.空气中CO和O2的比为1:10时,不会发生重度一氧化碳中毒
C.发现轻度一氧化碳中毒时,及时开窗通风有利于缓解中毒情况
D.使用煤炉在室内取暖可能会产生一氧化碳中毒
(3)将病人放入高压氧舱是治疗一氧化碳中毒的常用方法,试用化学反应原理简述其治疗原理_________。
(4)血红蛋白的携氧功能和其含有的二价铁(用Fe2+表示)关系密切,若误将亚硝酸钠摄人体内也会导致组织缺氧而中毒,写出在酸性条件下其反应的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com