
科目: 来源:不详 题型:单选题
| A.A12(SO4)3和NaHCO3 | B.Na2CO3和HCl |
| C.NaOH和A1C13 | D.AgNO3和NH3?H2O |
查看答案和解析>>
科目: 来源:珠海一模 题型:单选题
| A.比较Cu、Fe2+的还原性;Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性;氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol?L-1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性;高锰酸钾中加入浓盐酸 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
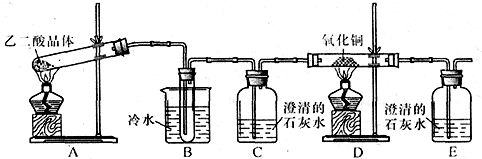
查看答案和解析>>
科目: 来源:不详 题型:问答题
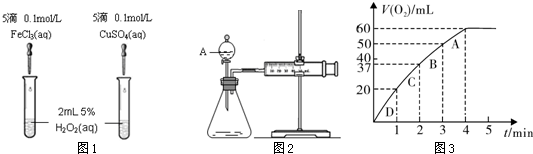
| 1 |
| 3 |
| 3 |
| 4 |
查看答案和解析>>
科目: 来源:枣庄一模 题型:问答题
| 实验 编号 |
KClO3/g | 氧化物 | 产生气体/mL (已折算到标况) |
耗时/s | ||
| 化学式 | 质量/g | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 90% | 67.2 | 188.3 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
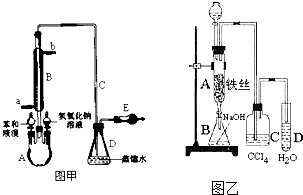
查看答案和解析>>
科目: 来源:不详 题型:问答题
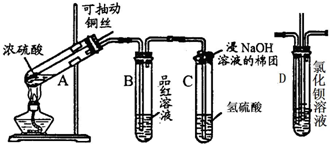
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
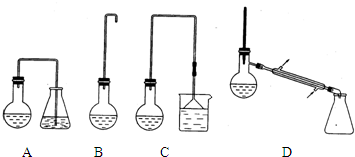
查看答案和解析>>
科目: 来源:不详 题型:填空题
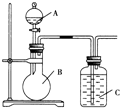
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com