水溶液是中学化学的重点研究对象.
(1)水是极弱的电解质,也是最重要的溶剂.常温下某电解质溶解在水中后,溶液中的c(H
+)=10
-9mol?L
-1,则该电解质可能是
CD
CD
(填序号).
A. CuSO
4 B. HCl C. Na
2S D.NaOH E.K
2SO
4(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(至少回答两种)
再通入氯气、加入碳酸盐、加入次氯酸钠
再通入氯气、加入碳酸盐、加入次氯酸钠
.
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10
-3mol?L
-1的氨水b L;②c(OH
-)=1.0×10
-3mol?L
-1的氨水c L;③c(OH
-)=1.0×10
-3mol?L
-1的氢氧化钡溶液d L.则a、b、c、d之间的关系是:
b>a=d>c
b>a=d>c
.
(4)强酸制弱酸是水溶液中的重要经验规律.
①已知HA、H
2B是两种弱酸,存在以下关系:H
2B(少量)+2A
-=B
2-+2HA,则A
-、B
2-、HB
-三种阴离子结合H
+的难易顺序为
A->B2->HB-
A->B2->HB-
.
②某同学将H
2S通入CuSO
4溶液中发现生成黑色沉淀,查阅资料并在老师的指导下写出了化学方程式:H
2S+CuSO
4=CuS↓+H
2SO
4,但这位同学陷入了困惑:这不成了弱酸制取强酸了吗?请你帮助解释
铜离子和硫化氢只所以能生成硫化铜沉淀,是因为硫化铜既难溶于水又难溶于酸
铜离子和硫化氢只所以能生成硫化铜沉淀,是因为硫化铜既难溶于水又难溶于酸
.
(5)已知:H
2A═H
++HA
-、HA
-?H
++A
2-,常温下,0.1mol?L
-1的NaH A溶液其pH=2,则0.1mol?L
-1的H
2A溶液中氢离子浓度的大小范围是:
0.1mol/L<c(H+)<0.11mol/L
0.1mol/L<c(H+)<0.11mol/L
;NaHA溶液中各种离子浓度大小关系为
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
.
(6)己知:Ksp(AgCl)=1.8×10
-10mol?L
-1,向50mL 0.018mol?L
-1的AgNO
3溶液中加入相同体积0.020mol?L
-1的盐酸,则c(Ag
+)=
1.8×10-7mol/L
1.8×10-7mol/L
,此时所得混合溶液的pH=
2
2
.

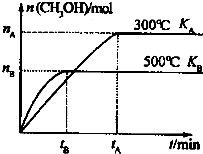 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.