
科目: 来源: 题型:选择题
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: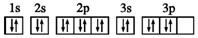 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分离甲苯和二甲苯混合物 | B. | 分离硝酸苯和水的混合物 | ||
| C. | 分离碳酸钡和碳酸钠溶液 | D. | 分离碘的四氯化碳和水 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
科目: 来源: 题型:解答题
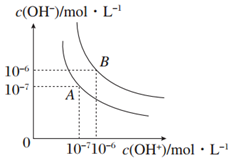 回答下列问题
回答下列问题查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液 | B. | 胶体 | C. | 浊液 | D. | 气溶胶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com