
科目: 来源: 题型:解答题
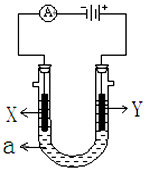 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:实验题
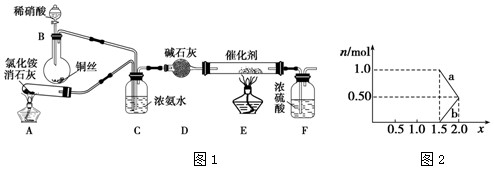
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
查看答案和解析>>
科目: 来源: 题型:解答题
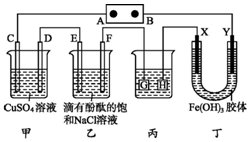 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com