
科目: 来源: 题型:选择题
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
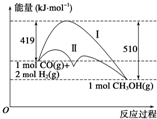 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
查看答案和解析>>
科目: 来源: 题型:填空题
 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯查看答案和解析>>
科目: 来源: 题型:选择题
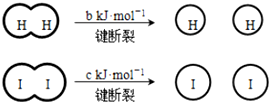 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开 1 mol H-H 键和1 mol I-I键所需能量大于断开 2 mol H-I键所需能量 | |
| C. | 断开 2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于 2a kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
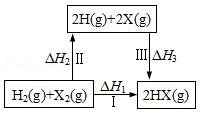
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
查看答案和解析>>
科目: 来源: 题型:实验题
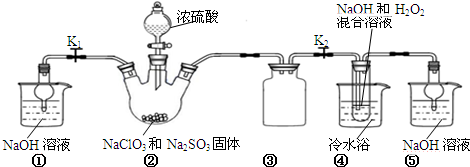
查看答案和解析>>
科目: 来源: 题型:实验题
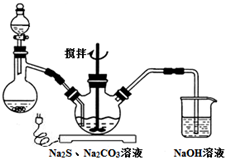 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com