
科目: 来源: 题型:选择题
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO3、H2SO4、H2SO3 | B. | SO2、H2SO3、H2SO4 | C. | SO3、H2SO3、H2SO4 | D. | SO2、H2SO4、H2SO3 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
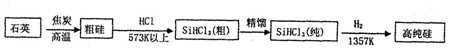
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、SO42-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Cu2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com