
科目: 来源: 题型:解答题
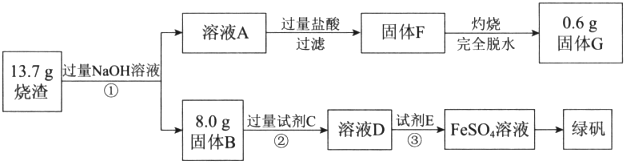
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③④ | D. | ③⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
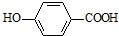 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$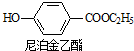 +H2O
+H2O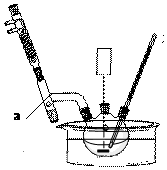
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.查看答案和解析>>
科目: 来源: 题型:实验题
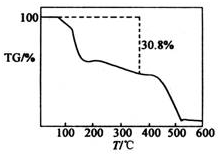 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com