
科目: 来源: 题型:实验题
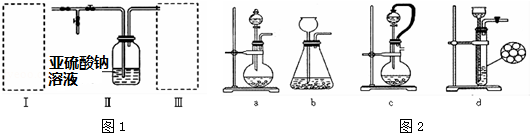
查看答案和解析>>
科目: 来源: 题型:解答题
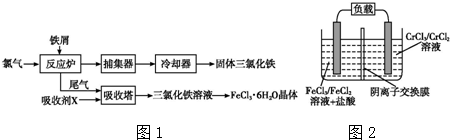
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和热一定是强酸跟强碱反应放出的热量 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l)△H=57.3KJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
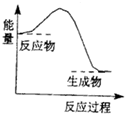
| A. | 生石灰溶于水 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4C1固体的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Q | B. | Q | C. | 1.8Q | D. | 0.9Q |
查看答案和解析>>
科目: 来源: 题型:解答题
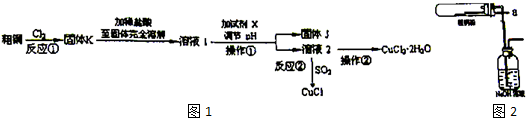
查看答案和解析>>
科目: 来源: 题型:解答题
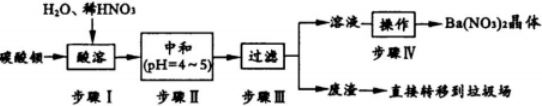
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com