
科目: 来源: 题型:选择题
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
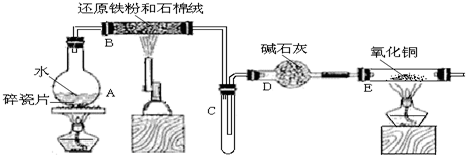
查看答案和解析>>
科目: 来源: 题型:解答题
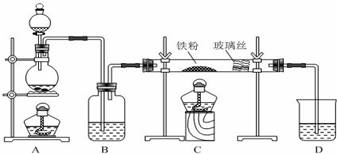
查看答案和解析>>
科目: 来源: 题型:解答题
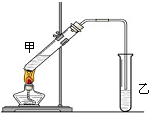 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: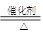 CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.
CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.查看答案和解析>>
科目: 来源: 题型:解答题
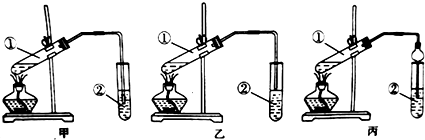
查看答案和解析>>
科目: 来源: 题型:解答题
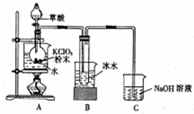 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
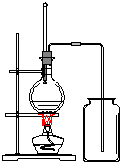 实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.
实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.查看答案和解析>>
科目: 来源: 题型:解答题
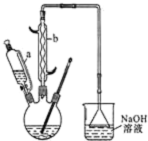 己二酸
己二酸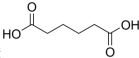 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目: 来源: 题型:解答题
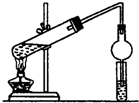 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.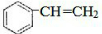 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为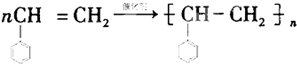 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com