
科目: 来源: 题型:实验题
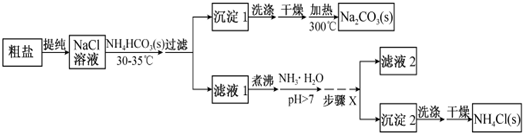
查看答案和解析>>
科目: 来源: 题型:实验题
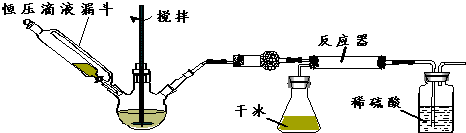
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
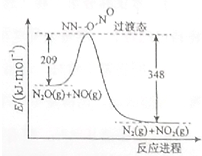 (1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
(1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.查看答案和解析>>
科目: 来源: 题型:实验题
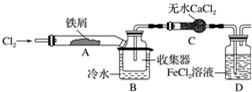 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
科目: 来源: 题型:实验题
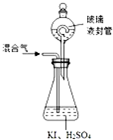 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题: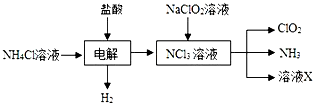
查看答案和解析>>
科目: 来源: 题型:解答题
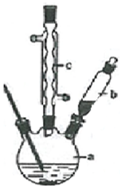 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: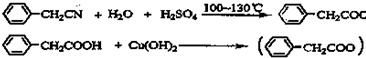
查看答案和解析>>
科目: 来源: 题型:多选题
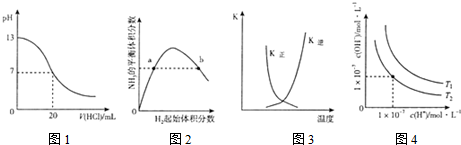
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
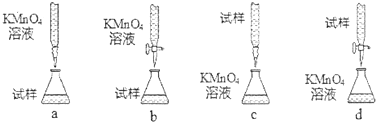
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com