
科目: 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
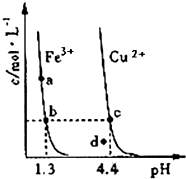 某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )| A. | 该温度下,Ksp[Fe(OH)3]>Ksp[Cu(OH)2] | |
| B. | c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等 | |
| C. | Cu(OH)2在c点比在d点代表的溶液中溶解程度小 | |
| D. | 加适量浓NH3•H2O可使溶液由a点变到b点 |
查看答案和解析>>
科目: 来源: 题型:选择题
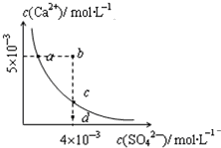 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
查看答案和解析>>
科目: 来源: 题型:选择题
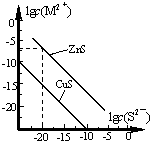 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目: 来源: 题型:选择题
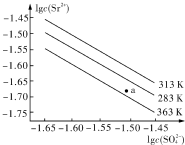
| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com