
科目: 来源: 题型:解答题
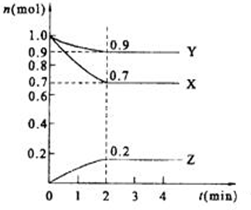 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BaSO4一定能转化为BaCO3 | B. | BaSO4一定不能转化为BaCO3 | ||
| C. | BaSO4有可能转化为BaCO3 | D. | 无法通过实验来验证是否发生转化 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 易溶于水 | B. | 此AgCl更难溶于水 | ||
| C. | 与AgCl一样难溶于水 | D. | 无法确定溶解性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中I-浓度减小 | B. | 溶度积常数Ksp增大 | ||
| C. | 沉淀溶解平衡向左移动 | D. | 溶液中Pb2+浓度增大 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Na2S溶液 | B. | AlCl3溶液 | C. | NaOH溶液 | D. | CaCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ?④>①=②>③ | B. | ?④>①>②=③ | C. | ?④=①>②>③ | D. | ?①=②>④>③ |
查看答案和解析>>
科目: 来源: 题型:解答题
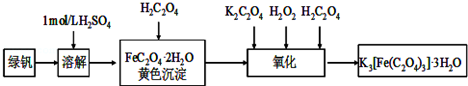
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com