
科目: 来源: 题型:选择题
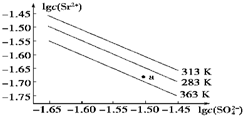
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
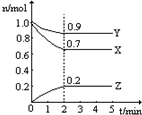 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 编号 | 改变的条件 | 正反应的速率 |
| ① | 降低温度 | |
| ② | 增大Y的浓度 | |
| ③ | 使用合适的催化剂 | |
| ④ | 增大容器体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
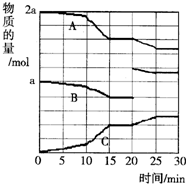
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
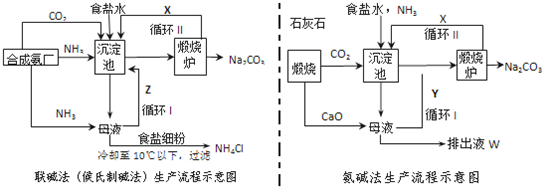
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | |||||||||
| B. | 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀并且其沉淀量多于AgCl沉淀 | |||||||||
| C. | 反应A(g)?2B(g)△H若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1 | |||||||||
| D. | 已知:
|
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com