
科目: 来源: 题型:解答题
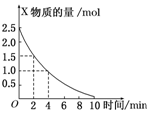 在容积为3L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y═2Z,如图所示是该反应中X的物质的量随时间变化的曲线.
在容积为3L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y═2Z,如图所示是该反应中X的物质的量随时间变化的曲线.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2摩尔质量是60 | |
| B. | 1 molSiO2中含有1 molO2 | |
| C. | 1.5 molSiO2中含有1.806×1024个氧原子 | |
| D. | 1 molSiO2质量是60 g•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | NH4+、K+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
| B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从海水中可以得到NaCl电解熔融NaCl可制备金属钠 | |
| B. | 海水蒸发制海盐的过程中不涉及化学变化 | |
| C. | 从海水中提溴、碘、镁单质,都利用了氧化还原反应 | |
| D. | 利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
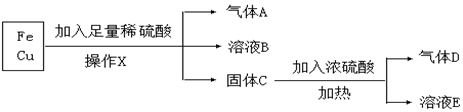
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com