
科目: 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | H2S | B. | SO2 | C. | SO2、O2 | D. | SO2、H2S |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目: 来源: 题型:实验题
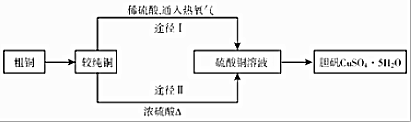
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
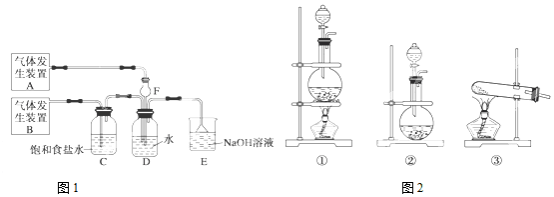
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于2.0Kpa | B. | 等于1.5Kpa | C. | 大于1.5bKpa | D. | 小于1.5bKpa |
查看答案和解析>>
科目: 来源: 题型:实验题
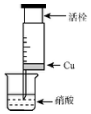 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 用途 |
| A | 硅单质 | 制作光导纤维 |
| B | 烧碱 | 治疗胃酸过多 |
| C | 铁罐车 | 常温下用于运输浓硝酸 |
| D | 液氨 | 用作消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com