
科目: 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
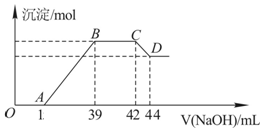
查看答案和解析>>
科目: 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | H2CO3 | HClO |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3×10-8 |
| A. | lmolCl2通入足量的水中充分反应,转移的电子数约为6.02×1023 | |
| B. | 将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O | |
| C. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值不变 | |
| D. | 向浓度均为1×103 mol/L-1的KC1和K2CrO4混合溶液中滴加1×10-3 mol/L-1的AgNO3溶液Cl-先沉淀 |
查看答案和解析>>
科目: 来源: 题型:实验题
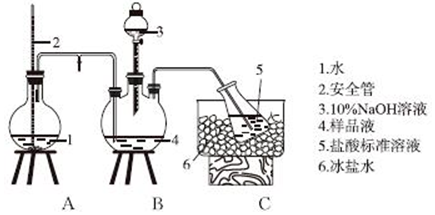
查看答案和解析>>
科目: 来源: 题型:实验题
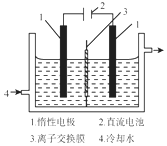 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.| 试验方法 | 实验现象及结论 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
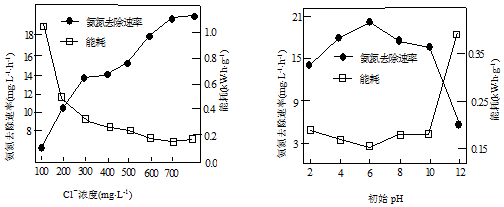
查看答案和解析>>
科目: 来源: 题型:解答题
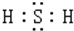 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com