
科目: 来源: 题型:解答题
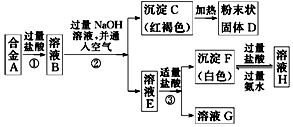 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
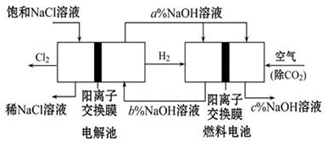
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将少量浓氨水滴入Al2(SO)4溶液 将少量Al2(SO4)3溶液滴入浓氨水 | |
| B. | 将少量SO2通入Ba(OH)2溶液 将过量SO2通入少量Ba(OH)2溶液 | |
| C. | 将0.1molCl2通入含0.2molFeBr2的溶液中 将0.3molCl2通入含0.2molFeBr2溶液 | |
| D. | 将过量BaCl2溶液与少量Na2SO4溶液相混合 将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )
X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )| A. | 原子半径:X>Y>Z>W | |
| B. | 简单气态氮化物的热稳定性:W>X | |
| C. | 最高价氧化物对应的水化物的碱性:Z>Y | |
| D. | X和W组成的化合物常作砂纸、砂轮的磨料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,6.0g NO和2.24L O2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,0.1mol Na2O和Na2O2组成的混合物中,阴离子的数目为0.1NA | |
| C. | C2H4和C3H6的混合物的质量为mg,所含碳氢键的数目为$\frac{3m}{14}$NA | |
| D. | 1mol甲基( )所含的电子数为7NA )所含的电子数为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com