
科目: 来源: 题型:选择题
| A. | 1.6gCH4与1.8gNH4+所含质子数均为NA | |
| B. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| C. | 0.5 mol•L-1Na2CO3溶液中,阴阳离子总数为1.5NA | |
| D. | 常温常压下,44gCO2气体中所含的分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O | |
| B. | Na2O2与H2O反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | c(NOCl)/mol•L-1 | v/mol•L-1•S-1 |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
| 化学键 | NO中的氮氧键 | Cl-C1 键 | C1-N 键 | N0C1中的N=0键 |
| 键能/KJ•mol-1 | 630 | 243 | a | 607 |

查看答案和解析>>
科目: 来源: 题型:选择题
 一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )
一定条件下,体积为10L的固定容器发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:下列说法正确的是( )| A. | t1min时正、逆反应速率相等 | |
| B. | X曲线表示NH3的物质的量随时间变化的关系 | |
| C. | 0~8 min,H2的平均反应速率 v(H2)=0.075mol•L-1•min-1 | |
| D. | 10~12 min,升高温度使反应速率加快,平衡正向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
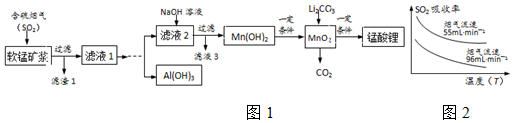
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  装置关闭止水夹,往长颈漏斗加水,根据水位的变化情况可检查该装置的气密性 | |
| B. |  装置可用来收集NH3、H2等 | |
| C. |  装置可用来吸收极易溶于水的气体如NH3、HCl等 | |
| D. |  装置洗涤沉淀物时,向漏斗中加蒸馏水至浸没沉淀物,滤出溶液并重复操作2-3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com