
科目: 来源: 题型:
| H | + 4 |
| O | 2- 4 |
| O | - 3 |
| O | 2- 3 |
| ||
| ||

查看答案和解析>>
科目: 来源: 题型:
 (1)某混合溶液中,可能含有的离子如下表:
(1)某混合溶液中,可能含有的离子如下表:| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ Mg2+ |
| 可能大量含有的阴离子 | Cl- Br- I- CO32- AlO2- |
查看答案和解析>>
科目: 来源: 题型:
| H | + 4 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
| c(CO) |
| c(H2) |
查看答案和解析>>
科目: 来源: 题型:
 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:查看答案和解析>>
科目: 来源: 题型:
 某实验小组利用电子天平来探究不同催化剂对双氧水分解速率的影响.取20mL某浓度的双氧水溶液,放入锥形瓶中,加入催化剂,假定溶液体积不随反应而变化.记录数据如下表(数据为表面皿、锥形瓶和试剂的总质量).
某实验小组利用电子天平来探究不同催化剂对双氧水分解速率的影响.取20mL某浓度的双氧水溶液,放入锥形瓶中,加入催化剂,假定溶液体积不随反应而变化.记录数据如下表(数据为表面皿、锥形瓶和试剂的总质量).| 催化剂 时间(g) 质量(g) |
0.1g MnO2 | 0.1g CuO |
| 0s | 192.500 | 192.500 |
| 5s | 192.180 | 192.420 |
| 10s | 192.020 | 192.380 |
| 15s | 191.940 | 192.360 |
| 20s | 191.940 | 192.352 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
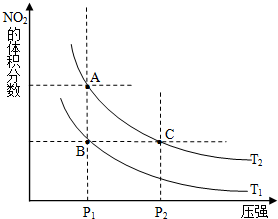 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com