
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-| n | 2 |
查看答案和解析>>
科目: 来源: 题型:






查看答案和解析>>
科目: 来源: 题型:
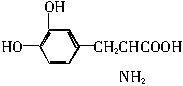 。这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。已知含碳、氢、氧、氮4种元素的有机物在空气中完全燃烧生成二氧化碳、水和氨气。
。这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。已知含碳、氢、氧、氮4种元素的有机物在空气中完全燃烧生成二氧化碳、水和氨气。查看答案和解析>>
科目: 来源: 题型:
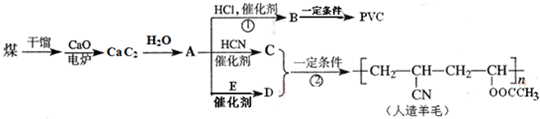
| 催化剂 |
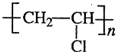
| 催化剂 |
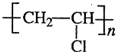
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||

| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | 0 |
| 5 | 0.0033 | 0.103 | 0.447 | 0 |
| 6 | 0.0319 | 0.0999 | 0.437 | 0 |
| 7 | 0.2745 | 0.086 | 0.3195 | 0 |
| 8 | 0.902 | 0.0282 | 0.0347 | 0 |
| 9 | 0.996 | 0.0031 | 0.0004 | 0 |
查看答案和解析>>
科目: 来源: 题型:
 (2009?梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
(2009?梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com