
科目: 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
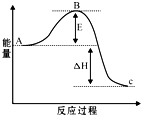 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:查看答案和解析>>
科目: 来源: 题型:

| 滴定次数 | 待测液体积 | 标准KOH溶液体积/ml | 滴定前读数/ml | 滴定后读数/ml | 第一次 | 20.00 | 0.02 | 25.00 | 第二次 | 20.00 | 0.01 | 25.03 | 第三次 | 20.00 | 0.03 | 26.35 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com