
科目: 来源: 题型:选择题
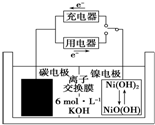 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-═2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
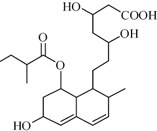 M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )
M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )| A. | M不能与FeCl3溶液发生显色反应 | |
| B. | 0.1mol M足量的Na反应可产生4.48LH2 | |
| C. | M能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
查看答案和解析>>
科目: 来源: 题型:选择题
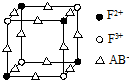
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用瓷坩埚灼烧氢氧化钠固体 | |
| B. | 中和热测定实验中可用铜制搅拌棒代替玻璃环形搅拌棒 | |
| C. | 用酸式滴定管量取12.00mL高锰酸钾溶液 | |
| D. | 用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 乙烯的结构简式为:CH2CH2 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.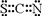 ]-,其中心原子采用sp杂化.
]-,其中心原子采用sp杂化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com