(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;第二:
该反应是放热反应
该反应是放热反应
.Na
2O
2跟水反应的化学方程式是
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.
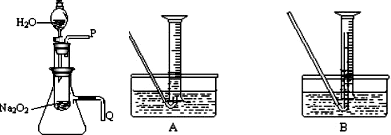
(2)某研究性学习小组拟用右图所示装置(气密性良好)
进行实验,以证明上述结论.
用以验证第一条结论的实验操作是:
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成
;
用以验证第二条结论的实验方法是:
将导管Q浸入水中,反应过程中导管口有气泡冒出
将导管Q浸入水中,反应过程中导管口有气泡冒出
.
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色.为探究其原因,该小组同学从查阅有关资料中得知:Na
2O
2与水反应可生成H
2O
2,H
2O
2具有强氧化性和漂白性.请设计一个简单的实验,验证Na
2O
2跟足量水充分反应后的溶液中有H
2O
2存在.(只要求写出实验所用的试剂及观察到的现象)
试剂:
MnO2
MnO2
;现象:
气泡迅速产生,能使带火星的木条复燃
气泡迅速产生,能使带火星的木条复燃
.
(4)该小组同学提出用定量的方法探究Na
2O
2跟水反应后的溶液中否含有H
2O
2,其实验方法为:称取2.6g Na
2O
2固体,使之与足量的水反应,测量产生O
2的体积并与理论值比较,即可得出结论.
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积)
B
B
(填序号),理由是
防止气体冷却时发生倒吸现象
防止气体冷却时发生倒吸现象
.
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
500mL
500mL
(选填“100mL”“200mL”“500mL”或“1000mL”).

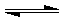 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).



 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.