
科目: 来源: 题型:选择题

| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
 写出B的氢化物的结构式:
写出B的氢化物的结构式: 用电子式表示A、C两元素形成AC2的过程:
用电子式表示A、C两元素形成AC2的过程: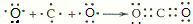
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因是放热反应,故不必加热反应就一定能发生 |
查看答案和解析>>
科目: 来源: 题型:解答题
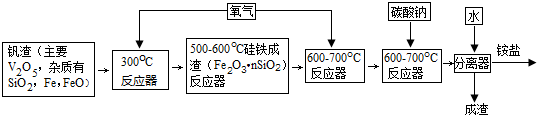
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
查看答案和解析>>
科目: 来源: 题型:解答题

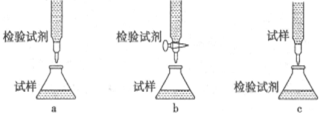
查看答案和解析>>
科目: 来源: 题型:填空题
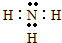 ,
,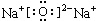 (或
(或 ).
).查看答案和解析>>
科目: 来源: 题型:填空题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质B的转化率降低 | ||
| C. | x+y<z | D. | 物质C的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com